Химия и химические технологии/
6. Органическая химия
Пырко А.Н.
Международный государственный экологический университет
имени А.Д. Сахарова, г. Минск,
Беларусь
Синтез три-
и тетрациклических соединений взаимодействием
2-ацетил-1,3-циклогексен-1-олов
с 1,3-декалиндионами и
4-гидроксикумаринами
В самом начале (1935) изучения путей полного синтеза
стероидов Робинсоном и сотр. была разработана АВ →АВD→АВСD- схема
построения циклопентано- и циклогексанофенантренового скелета реакцией
α-тетралонов с ацетилцикленами (1a,b ) [1]. Использование в этой схеме гетероциклических
аналогов α-тетралонов или ацетилцикленов позволяет получить аналоги
стероидов с гетероатомом в циклах А, В и D[2,3,4]. Однако в полученных таким образом соединениях
отсутствуют характерные для природных стероидов кислородной функции либо
боковой цепи в положении 17 (17а). Попытки введения их химическими [5] или
микробиологическими [6] методами в уже сформированную молекулу были
безуспешными. Один из возможных путей получения стероидных структур (2),
содержащих 12,17 дикарбонильные функции, заключается в использовании в данной
схеме ацетилцикленов (3a,b), содержащих функциональный заместитель в соседнем с
ацетильной цепью аллильном положении молекулы. Впервые соединения такого типа –
ацетилциклогексеноны (3b) были получены
в 1972 году [7]. При этом было показано, что они легко изомеризуются при
нагревании и в присутствии кислот и оснований в кетодиенолы (4b) (Схема 1), которые не могут быть использованы в
качестве акцепторов реакции сопряженного присоединения по Михаэлю с
енолят-анионами α-тетралонов.
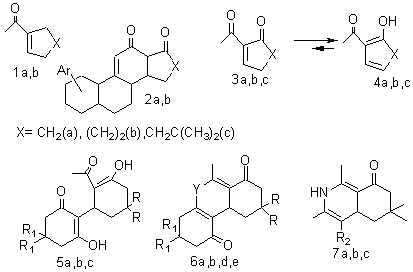 Схема 1
Схема 1
R = H, R1 = CH3,
R2 = CN, Y=O (a); R = R1 = CH3, R2
= COCH3, Y = O (b); R = CH3, R1 =
H, R2 = CO2CH2CH3 (c); R = R1
= H, Y = NH (d); R = R1 = CH3, Y = NH (e)
Нами был разработан эффективный
двухстадийный способ [8] получения кетодиенолов (4b,c) из
соответствующих 2-ацетилциклогексан-1,3-дионов, что позволило изучить их
химические свойства. Было показано, что в присутствии оснований они легко
вступают в реакции взаимодействия с 1,3-циклогександионами, давая аддукты
михаэлевского присоединения (5a,b,c). Их
дегидратация в присутствии кислоты приводила к формированию пиранового цикла с
образованием трициклов (7a,b,с). Взаимодействием кетодиенолов с
β-енаминокетонами были получены новые производные гексагидроизохонолона (8a,b,c) и декагидрофенантридина (7d,e)[9]. В данной работе
описывается синтез три- и тетрациклических соединений взаимодействием кетодиенолов
(4b,c) с декалиндионами-1,3
и 4-гидроксикумаринами.
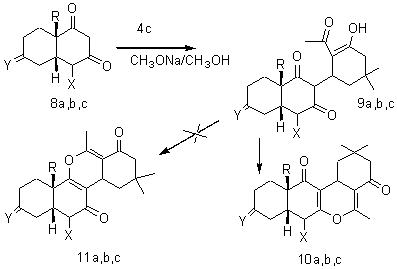 Схема 2
Схема 2
X = H, Y = H2 , R = H (a); X = CO2CH2CH3,
Y = H2, R = H (b); X = CO2CH2CH3, Y
= O, R = CH3
С целью выхода к соединениям, включающим тетрациклический
стероидный скелет, изучено взаимодействие кетодиенола (4с) с бициклическими
β-дикетонами (8a,b,c). Как и
1,3-циклогександионы 1,3-декалиндионы (8a,b,c) в присутствии метилата натрия легко вступают в
реакцию присоединения по Михаэлю с кетодиенолом (4с), давая трициклические
тетракетоны (9a,b,c). Структура
полученных соединений соответствует спектральным данным. Нагреванием трициклов
(9a,b,с) в бензоле в
присутствии Р2О5 получено по одному соединению, которым
приписана структура (11a,b), а не их изомерам (10a,b,с), потому что
в работе [10] показано, что образование ∆2-енольных
производных декалиндионов-1,3 происходит значительно чаще, чем их ∆1-аналогов.
Попытки осуществить альдольную конденсацию путем нагревания соединений (9a,b,с) в среде MeONa/MeOH приводили к
ретромихаэлевскому распаду (Схема 2).
Взаимодействие замещенного кетодиенола (4с) с
4-оксикумаринами (12a,b) протекает по типу михаэлевского присоединения давая
трициклы (13a,b), а незамещенного кетодиенола (4b) с 4-оксикумарином (12а) – по типу диеновой
конденсации, давая тетрацикл (14). Нагревание соединений (13a,b,14) в бензоле
в присутствии Р2О5 приводит к диоксааналогам стероидов
(15a,b,с), а не изомерным
им тетрациклам (16a,b,с) (Схема 3).
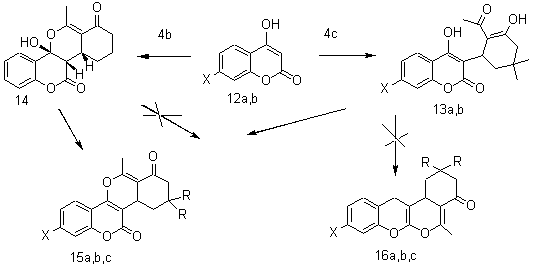 Схема 3
Схема 3
X = R = H (a); X = OH, R = CH3 (b); X = H, R = CH3
(с)
Литература
1 J. R. Hawthorne, R. Robinson, Journal of the Chemical Society, 1936,
pp. 763-765.
2.Cagniant, Comptes
Rendus Hebdomadaires des Seances de l Academie des Sciences, Vol. 256, No.22, 1963, pp. 4674-4676.
3. M. Schaefer, J. Weber, P. Faller, Synthesis, 1979, No 2, pp. 122-133.
4. G. Jacob, D. Cagniant, Comptes Rendus Hebdomadaires des Seances de l Academie des Sciences,
Vol. 284, No. 9, 1977, pp. 373-375.
5. R. Robinson, S. Slater, Journal of the Chemical Society, No.7, 1941, pp. 376-385.
6. M.
J. Ashton, A. S. Bailey, E. R. H.
Jones, Journal of the Chemical
Society Perkin I, No.14, 1974, pp. 1658-1665.
7. A.
A. Akhrem, A. M. Moiseenkov and F. A. Lakhvich, Russian Chemical Bulletin, Vol. 21, No. 4, 1972, pp. 866-868.
8. А.
А, Ахрем, Ф. А. Лахвич, А. Н. Пырко, ЖОрХ. 19, № 11, 2322-2328, (1983)
9.Ya. Ya. Ozols, A.
N. Pyrko, B. A. Vigante, R. R. Dubure, G. Ya. Dubur, Chemistry of Heterocyclic Compounds, Vol. 28, No. 5, 1992, pp.
530-534.
10. Ch. Tamm, R.
Albrecht, Helv. Chim. Acta, Vol. 43,
No.3,1960, pp. 768–782.