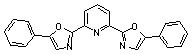И. Ю.Севрюков, В. В.Щербань, Л. Л. Лукацкая, З.
А. Сизова, А. О. Дорошенко
Научно-исследовательский
институт химии Харьковского национального
университета им. В.Н. Каразина. Украина, 61077,
Харьков, пл. Свободы, 4
Квантово-химическое моделирование комплексообразования
2,6-бис-(5-фенил-1,3-оксазол-2-ил)-пиридина
В последнее время
широкий интерес исследователей в области физической органической химии
привлекает проблема получения новых чувствительных селективных флуороионофоров
для обнаружения металлов и количественного определения концентрации ионов
металла [1, 2]. Это обусловлено необходимостью решения проблем загрязнения
окружающей среды ионами тяжелых металлов. Так, неорганические соединения
ртути, представляющие наибольшую опасность для организма человека, попадают в
атмосферу в виде паров Hg (0), в природные воды – преимущественно в виде
солей Hg(II) из различных естественных (лесные пожары, вулканическая деятельность)
и антропогенных источников (горнодобывающая промышленность, сжигание моторных
топлив, выбросы химических производств и т.д.) [3].
 Флуоресцентный хемосенсор должен
объединять в одной молекуле фрагмент эффективного флуорофора и
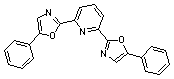
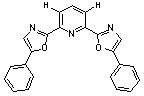
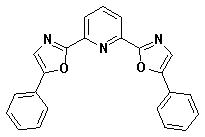
комплексообразующие группы. Этим условиям удовлетворяет 2,6-бис-(5-фенил-1,3-оксазол-2-ил)-пиридин
(I), который может существовать в нескольких
конформациях, различающихся относительным пространственным расположением
центрального пиридинового и двух оксазольных циклов. Оценка конформационного
состава была проведена различными расчетными методами (табл. 1).
Флуоресцентный хемосенсор должен
объединять в одной молекуле фрагмент эффективного флуорофора и
комплексообразующие группы. Этим условиям удовлетворяет 2,6-бис-(5-фенил-1,3-оксазол-2-ил)-пиридин
(I), который может существовать в нескольких
конформациях, различающихся относительным пространственным расположением
центрального пиридинового и двух оксазольных циклов. Оценка конформационного
состава была проведена различными расчетными методами (табл. 1).
Согласно
представленным результатам наиболее энергетически выгодной для исследуемого
соединения является конформация С с
анти-ориентацией друг относительно друга его потенциальных центров
комплексообразования – атомов азота пиридинового и обоих оксазольных циклов.
Причиной её аномально высокой стабильности может быть взаимодействие атомов
водорода в положениях 3 и 5 пиридинового цикла с неподеленными электронными
парами атомов азота оксазольных циклов, которое может рассматриваться как
преимущественно электростатическое. Таким образом, пространственная форма
молекулы I, в которой три её атома азота
формируют хелатную полость для координации иона металла, достаточно неожиданно
для нас оказалась наименее вероятной.
Таблица 1. Результаты конформационного анализа соединения I в основном
состоянии по данным квантово-химического моделирования
|
Конформация |
Метод АМ1 |
Метод РМ3 |
Метод РМ6 |
Метод b3lyp/ ccPVDZ |
||||
|
DDH, ккал/ моль |
Состав равновесной смеси |
DDH, ккал/ моль |
Состав равновесной смеси |
DDH, ккал/ моль |
Состав равновесной смеси |
DDH, ккал/ моль |
Состав равновесной смеси |
|
|
|
0.87 |
18% |
1.87 |
4% |
2.01 |
3% |
2.35 |
2% |
|
|
2.22 |
2% |
4.41 |
0% |
4.94 |
0% |
5.46 |
0% |
|
C |
0 |
80% |
0 |
96% |
0 |
97% |
0 |
98% |
Для ответа на вопрос, формируется ли в
молекуле I хелатная полость для координации ионов металла, мы
провели квантово-химическое моделирование продуктов его взаимодействия с
простейшим положительно заряженным ионом – протоном (табл. 2). При этом мы
рассматривали случаи присоединения протона только по атому пиридинового цикла,
являющегося наиболее сильным основным центром в изучаемой молекуле.
Согласно полученным данным (табл. 2),
наиболее энергетически выгодной конформацией продукта присоединения протона к
молекуле I является BН+,
в которой катион находится в хелатной полости, сформированной тремя атомами
азота. Ионы большего размера должны в ней удерживаться более прочно. В
соответствии с принципом ЖМКО Пирсона можно также предположитьдополнительное
усиление связывания для таких мягких кислот Льюиса, как ион Hg2+, поскольку
сам органический лиганд I относится к классу мягких оснований.
Таблица 2. Конформации монопротонированных катионных форм
соединения I в основном состоянии по данным квантово-химического
моделирования
|
Конформация |
Метод АМ1 |
Метод РМ3 |
Метод РМ6 |
Метод b3lyp/ ccPVDZ |
||||
|
DDH, ккал/моль |
Состав равновесной смеси |
DDH, ккал/моль |
Состав равновесной смеси |
DDH, ккал/моль |
Состав равновесной смеси |
DDH, ккал/моль |
Состав равновесной смеси |
|
|
AН+ |
0.55 |
27% |
1.74 |
5% |
1.07 |
14% |
1.72 |
5% |
|
BН+ |
0 |
70% |
0 |
95% |
0 |
86% |
0 |
95% |
|
CН+ |
1.78 |
3% |
4.21 |
0% |
3.33 |
0% |
4.87 |
0% |
Таким образом, комплексообразование
соединения I с ионами металлов должно сопровождаться изменением
конформации органического лиганда, а движущей силой этого процесса будет выступать
общий выигрыш в энергии при образовании хелатного комплекса.
Литература:
[1]. De Silva A.P.,
Gunarante H.Q.N., Gunnlaughson T., Huxley A.J.M., Coy C.P., Rademacher J.T.,
Rice T.E. Signaling recognition events with fluorescent sensors and switches //
Chem. Rev.- 1997.- V.- 97.- P. 1515-1566.
2. Prodi L.,
Bolletta F., Montalti M., Zaccheroni N. Luminescent chemosensors for transition
metal ions // Coord. Chem. Rev.- 2000.- V. 205.- P. 59-83.
3. Malm O. Gold
Mining as a Source of Mercury Exposure in the Brazilian Amazon // Environ.
Res.- 1998.- V. 77.- P. 73-78.