Биологические науки, 9
Кубрак О.І., Лущак В.І.
Кафедра
біохімії, Прикарпатський національний університет імені Василя Стефаника,
Україна, 76025, Івано-Франківськ, вул. Шевченка, 57
Розробка нових способів
визначення активності α-амілази
α-Амілази відносяться до найбільш поширених промислових ензимів, загальний їх обіг у
світовому масштабі становить 156 мільйонів доларів. Так, α-амілази знайшли
застосування в різних галузях народного господарства [7], а нещодавно − і
в медицині [4]. У всіх випадках надзвичайно важливе значення має коректне визначення
активності α-амілаз. На даний час існує дуже багато методів для визначення
амілолітичної активності, і всі вони відзначаються як беззаперечними
перевагами, так і значними недоліками, що пояснюється специфічністю дії
амілолітичних ферментів і складністю будови субстрату.
Як препарат ферменту використовували зовнішньоклітинні
α-амілази з середовища культивування бактерій роду Bacillus.
Модифікація йодометричного методу нами розроблена з врахуванням відомих методик
[3,9]. Активність ферменту розраховували з формулою:
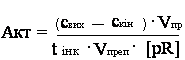
де: свих
– вихідна концентрація крохмалю у пробах, мг/мл (0,1 мг/мл); скін –
кінцева концентрація крохмалю у пробах, розрахована за рівнянням
калібрувального графіку, мг/мл; Vпр – об’єм проби, мл (1,25 мл); tінк –
час інкубації ферменту з субстратом, хв (15); Vпреп – об’єм ферментного препарату, мл; [pR] – концентрація загального білка, мг/мл.
Кінцеві концентрації крохмалю в пробах обчислювали, використовуючи рівняння
лінійної регресії, отримане за допомогою калібрувального графіку. Нами також було адаптовано відомий ферментативний метод визначення глюкози [1] для
визначення глюкози як одного з продуктів α-амілазної реакції:
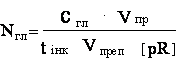
де: Nгл –
кількість утвореної глюкози, мг; сгл – концентрація глюкози у
пробах, розрахована за рівнянням калібрувального графіку, мг/мл. Решту
позначень – аналогічні до попередньої формули. В основу нефелометричного методу
покладена здатність розчину нежелатинізованого крохмалю розсіювати світло. Нами
реєструвалося зменшення розсіювання світла розчину сирого крохмалю після
обробки його препаратом α-амілази. Активність ферменту при використанні
даного методу можна обчислювати за наступною формулою:
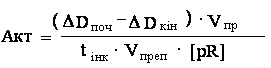
де: DDпоч і DDкін −
оптична густина розчину сирого крохмалю до гідролізу α-амілазою і після
реакції, відповідно (l=600 нм). Решта позначень – аналогічні до
попередньої формули. Розроблений нами мікроекспрес-метод визначення амілазної
активності ґрунтується на класичному тесті ідентифікації амілолітичної
активності колоній бактерій, висіяних на чашки Петрі [8].
Перевагою запропонованої нами модифікації йодометричного
методу є вища точність, що зумовлюється розрахунком концентрації крохмалю в
кожній пробі за допомогою рівняння лінійної регресії, отриманим за результатами
калібрувального графіку, тоді як у більшості відомих модифікацій даного методу при
визначенні активності використовують не значення концентрацій субстрату
(крохмалю), а тільки значення оптичних густин дослідного і контрольного
зразків. Запропонована формула розрахунку активності дозволяє нормувати
кількість розщепленого субстрату відносно кількості доданого ферментного
препарату. Підібрані оптимальні концентрації крохмалю (0,1-0,2 мг/мл кінцева
концентрація) та час інкубації ферменту з субстратом (15 хв при 40°С). Доведено,
що за умови перерахунку оптичних густин дослідних проб відносно рівняння
регресії, отриманого за значеннями оптичних густин проб калібрувального
графіку, активність ферменту не залежить ні від концентрації J2 i KJ, ні від довжини хвилі (звичайно в межах поглинання комплексу крохмаль J2-KJ: 500-700 нм). Модифікація глюкозооксидазного
методу надає можливість визначати один з основних продуктів амілазної реакції
− α-D-глюкозу,
незважаючи на присутність інших продуктів реакції (мальтози олігосахаридів та
декстринів), тоді як при застосуванні поширеного методу визначення редукуючих цукрів [6] реєструються декстрозні
еквіваленти всіх продуктів реакції, незалежно від кількості мономерних одиниць
у них. Нефелометричний метод дозволяє ідентифікувати і визначати активність тих
амілаз, які здатні гідролізувати сирий крохмаль [2, 5]. Слід зауважити, що для
коректного визначення оптичної густини проб з використанням нерозчиненого
крохмалю надзвичайно важливим є постійне їх перемішування (як у процесі
інкубації з ферментом, так і при спектрофотометричному вимірюванні) і
кількаразовий повтор кожного вимірювання для зменшення похибки, зумовленої
осадженням крохмальних гранул. Перспективним і ефективним для скринінгу великої
кількості зразків, особливо на етапах попереднього їх аналізу є
мікроекспрес-метод визначення активності α-амілази, тому може бути вдалою
альтернативою більш трудомістких методів. Нами доведена дієвість та
ефективність даного методу при визначення амілазної активності у будь-якому
препараті ферменту, зокрема у зразках, концентрація білка в яких становить 10-20 мкг/мл.
Час реакції залежить від типу використаного крохмалю і становить 3-10 хв. Метод
відрізняється простотою виконання і дешевизною. Як субстрат можна застосовувати
навіть харчовий крохмаль. Даний метод є напівкількісним, проте його можна
застосовувати для отримання кількісних показників активності, пронормувавши
діаметр зони гідролізу відносно кількості доданого ферментного препарату.
Запропоновані нами методи визначення активності амілаз
можуть бути ефективно використані для конкретних цілей, зокрема, вони можуть
значно полегшити попередній аналіз виділених з природних продуцентів амілаз,
допомогти виділити ферменти, здатні гідролізувати нерозчинений крохмаль, чи
підібрати умови для отримання максимальної продукції глюкози з крохмалю, тощо.
ЛІТЕРАТУРА
1.
Северин С.Е., Соловьева Г.А. Практикум по биохимии. – М.: Из-во Московського у-та, 1989. – 509 с.
2.
Hamilton L.M., Kelly C.T., Fogarty
W.M. Raw starch degradation by the non-raw starch-adsorbing bacterial
alpha-amylases of Bacillus sp. IMD 434. // Carbohydr. Res. – 1998. – 314. – P. 251–257.
3.
Fuwa H. A new method for microdetermination
of amylase activity by the use of amylose as the substrate. // J. Bochem. –
1954. – 41. – P. 583–603.
4.
Kandra L. α-Amylases of medical
and industrial importance. // J. Mol. Structure (Theochem). –
2003 – 666–667. – P. 487–498.
5.
Lin L.L., Chyau C.C., Hsu W.H.
Production and properties of a raw starch-degrading amylase from the
thermophilic and alkalophilic Вacillus sp.
TS-23. // Biotechnol. Appl. Biochem. – 1998. – 28. – P. 61–68.
6.
Miller G.L. Use of dinitrosalicilic acid reagent for determination of reducing sugar. // Anal Chem. –
1959. – 31. – P.
426–428.
7.
Pandey A., Nigam P. Advances in microbial amylases // Biotechnol. Appl.
Biochem. – 2002. – 31. – P. 145–152.
8.
Sneath P. Endospore-forming Gram-positive rods and cocci. In: Bergey’s
Manual of systematic bacteriology. – 1986. – v.2, section 13. –
P. 1105–1139.
9.
Xiao Z., Storms R., Tzang A. A
quantitative starch-iodine method for measuring alpha-amylase and glucoamylase
activities. // Anal. Biochem. – 2006. – 351.
– P. 146–148.