Кузьмич Н.Н., Петина О.А., Лалаев Б.Ю.,
Яковлев И.П., Ананьева Е.П.
Санкт-Петербургская
химико-фармацевтическая академия, Санкт-Петербург
Синтез 2-арил
(гетерил)-4Н-1,3,4-окса(тиа)диазин-5,6-дионов – путь к созданию нового
класса биологически активных веществ
Производные
1,3,4-оксадиазинов представляют интерес для исследований не только с точки
зрения теоретической органической химии, но и с точки зрения поиска новых
лекарственных субстанций. В их ряду обнаружены соединения, проявляющие
различные виды биологической активности – антимикробную, противовирусную,
встречаются ингибиторы МАО-оксидазы и антиконвульсанты.
Однако 4Н-1,3,4-оксадиазин-5,6-дионы
остаются вплоть до настоящего времени малоизученными соединениями, сведения в
литературе об их биологической активности отсутствуют, а рассматриваемые 1,3,4-оксадиазин-5,6-дионы,
незамещенные в положении 4, до сих пор не описаны.
Нами предложен метод
получения новых, ранее не упоминавшихся в литературе 4Н-1,3,4-оксадиазин-5,6-дионов,
содержащих в положении 2 ароматические или гетероароматические заместители,
заключающийся во взаимодействии гидразидов соответствующих карбоновых кислот и оксалилхлорида
в среде кипящего бензола, хлороформа или тетрахлорметана при концентрации
реагентов в интервале 5-10%. Выходы продуктов составляют 75-85% и практически не
зависят от строения радикалов R (схема 1).
Схема 1
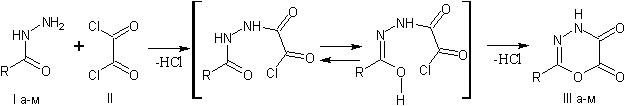
R=Ph (а), 3-NO2-Ph (б), 4-NO2-Ph
(в), 3,5-NO2-Ph (г), 3-Cl-Ph (д), 4-Cl-Ph (е), 3-Br-Ph (ж), 2,4-Cl-Ph
(з), 3-MeO-Ph (и), 4-MeO-Ph (к), 2-Fu (л), 2-Tn (м)
Взаимодействие
2-замещеных 4Н-1,3,4-оксадиазин-5,6-дионов с N- и О нуклеофилами было изучено на
примере соединения IIIa (схема 2). Реакция с метанолом происходит с раскрытием цикла
по положению 6 с образованием метилового эфира (2-бензоилгидразино)
оксоуксусной кислоты. Действие аминов приводит к образованию соответствующих
амидов кислоты (Vа-д). В случае
о-фенилендиамина реакция шла дальше и приводила к образованию
2,3-дигидроксихиноксалина. Взаимодействие оксадиазина IIIa с N-нуклеофильными реагентами протекало
достаточно гладко, и в случае фенилгидразина нагревания не требовалось.
Схема 2

R1, R2=H, Bu (Va); (CH2)2O(CH2)2 (Vб); H, NHPh (Vв); H, NHCOPh (Vг);
H, NHCO-4-Py (Vд)
Строение полученных
соединений было подтверждено методами ЯМР 1Н и 13С, ИК- и
масс-спектроскопии.
На кафедре микробиологии
СПХФА было изучено антимикробное действие полученных оксадиазинов. Испытание
проводилось методом серийных разведений.
Синтезированные соединения оказывают
слабое антимикробное действие. Наиболее активным в отношении бактерий Staphylococcus aureus оказалось вещество IIIг. МПК (минимально подавляющая
концентрация) его на штамм 209 Staphylococcus aureus составляет 62,5 мкг/мл. В целом же
данные оксадиазины оказались более активными в отношении грамположительных
бактерий. Рост дрожжей Candida albicans подавлялся незначительно (таблица 1).
Таблица 1
|
Соединение |
Тест-культуры |
LD50,
мг/кг |
||
|
№ |
St. aureus |
E. coli |
C. albicans |
|
|
МПК |
МПК |
МПК |
||
|
IIIа |
1000 |
>1000 |
500 |
1054 |
|
IIIб |
1000 |
250 |
1000 |
— |
|
IIIв |
500 |
>1000 |
1000 |
1041 |
|
IIIг |
62,5 |
1000 |
1000 |
— |
|
IIIд |
1000 |
1000 |
1000 |
1039 |
|
IIIе |
500 |
1000 |
500 |
— |
|
IIIж |
1000 |
1000 |
1000 |
— |
|
IIIз |
250 |
>1000 |
1000 |
— |
|
IIIи |
1000 |
>1000 |
1000 |
1069 |
|
IIIк |
1000 |
>1000 |
1000 |
— |
|
IIIл |
250 |
>1000 |
1000 |
— |
|
IIIм |
250 |
>1000 |
>1000 |
— |
Для четырех из полученных
оксадиазинов проводилось исследование некоторых других видов биологической
активности. Вначале по методу Миллера-Тейнтера на белых мышах была исследована
острая токсичность. Было установлено, что эти вещества являются относительно
малотоксичными (таблица 1), причем в данном ряду природа заместителей в
бензольном кольце на токсичность не влияла.
В опытах на белых крысах
проводилось изучение влияния соединений IIIа, в, д, и на этологические
показатели в тесте «открытое поле» и на воспроизведение энграмм памяти с
помощью методики определении условий пассивного избегания (УРПИ). Препаратами
сравнения служили сибазон и ноотропил. Наиболее интересным оказалось соединение
IIIв, которое
проявило заметное транквилизирующее действие в сочетании с ноотропным на уровне
ноотропила.
Представляется
целесообразным дальнейшее изучение действия соединения IIIв на высшие функции ЦНС животных.
Полученные данные
подтвердили прогноз спектра биологической активности, полученный при помощи
программы PASS.
Недавно путем
взаимодействия тиобензгидразида (VIII) с оксалилхлоридом (II) нами был получен до сих пор не описанный в
литературе 2-фенил-4Н-1,3,4-тиадиазин-5,6-дион (IX). Строение полученного соединения
было доказано методом ЯМР 1Н-спектроскопии. Реакция (схема 3)
проводилась при концентрации реагентов 4-6% и избытке оксалилхлорида 10% в
среде бензола при перемешивании (1,5ч) и последующем кипячении (0,5ч), а также
в среде хлороформа при умеренном кипении в течение 2ч. Выходы составили соответственно 83% и 90%.
Схема 3
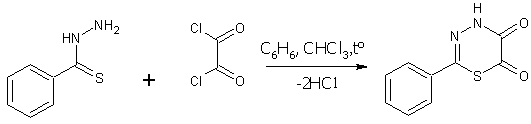
VIII II
IX
Для полученного 2-фенил-4Н-1,3,4-тиадиазин-5,6-диона
(V) при помощи
программы PASS был
получен прогноз спектра биологической активности. С высокой вероятностью (более
50%) предсказывается, в частности, противовоспалительная, антимикобактериальная
и противовирусная активности.
В дальнейшем планируется изучение острой токсичности, антимикробной
и других видов биологической активности 2-замещенных-4Н-1,3,4-тиадиазин-5,6-дионов.
Литература:
1.
van Alphen, J.// Rec. Trav. Chim. – 1928. – Vol. 47. – P. 673-682.
2. van
Alphen, J.// Rec. Trav. Chim. – 1928. – Vol. 47. – P. 909-919.
3. van
Alphen, J.// Rec. Trav. Chim. – 1934. – Vol. 53. – P. 325-354.
4. Kornet,
M. J. // J. Heterocyclic Chem. – 1996. – Vol. 33, №6. – P. 2047-2055.
5. Kim,
H. S., Kurasawa, Y. // Heterocycles. – 1998. – Vol. 49. – P. 557-586.
6.
Jensen K. A., Pedersen C. // Acta
Chem. Scand. – 1961. -
Vol. 15.
– P. 1087.
7.
Беленький,
М.Л. Элементы количественной оценки фармакологического эффекта. – Л.: Медицина,
1963. – 151 с.
8.
Шабанов,
П.Д. Воспроизведение пассивного избегания у крыс с помощью введения
фармакологических агентов./ Журн. Высш. Нервн. Деятельности им. Павлова. 1981. –
Т.31, №1. – С.158-163.
9.Кругликов, Р.И. Нейрохимические основы обучения и памяти. – М.: Наука, 1981. – 211с.