УДК 541.13
ЭЛЕКТРОХИМИЧЕСКОЕ ПОВЕДЕНИЕ ВАНАДИЯ ПРИ
ПОЛЯРИЗАЦИИ ПРОМЫШЛЕННЫМ ПЕРЕМЕННЫМ ТОКОМ
п.ғ.к., профессор Б.У. Курбаналиев,
А.Байтұрсынов
атындағы №1 жалпы орта мектеп КММ-нің химия
пәнінің мұғалімі Д.У. Усенбаева
Исследовано влияние различных параметров (плотности
тока, концентрации раствора, продолжительности электролиза, температуры
растворов, а также природы второго вспомогательного электрода) на
электрохимическое растворение ванадия при поляризации переменным током
промышленной частоты.
Задача данной работы состояла в изучении свойств
металлического ванадия при поляризации переменным током промышленной частоты
(50Гц) в растворах хлорида натрия. Изучение влияния различных параметров
(плотности тока, концентрации хлорида натрия, продолжительности электролиза,
температуры раствора, а также природы вспомогательного электрода) на выход по току растворения ванадия.
Исследования проводили в 0,1-4,0 М растворах хлорида натрия. Перед началом
исследований по электрорастворению металлического ванадия при поляризации
промышленным переменным током в нейтральных растворах были изучены
термодинамические условия образования соединений ванадия, приведенные в
диаграмме Пурбе /1/, Анализируя диаграмму Пурбе для ванадия можно
прогнозировать, что в нейтральных средах при анодной поляризации может
образовываться различные кислородсодержащие соединения трехвалентных и
пятивалентных ионов
Электролиз проводили
в стеклянном электролизере
объемом 150 мл. В качестве рабочего
электрода использовали металлический ванадий марки ВнПл-1, с объемным
содержанием основного металла 99,48 %.
Вспомогательным электродом служил - графит (основные опыты), а также ванадий,
титан. Площадь рабочей поверхности обоих электродов составила 2 см2
(исключение - титан). Основные опыты проводили при комнатной температуре без
разделения электродных пространств.
При идентификации (химическим
путем) продуктов растворения ванадиевого электрода в растворах 0,1 - 4,0 М NaСl были
обнаружены только ионы ванадия (V), а на поверхности электрода образовывался
пленка оксида ванадия (ІІІ). Соли ванадия (V) очень разнообразны по составу, их целесообразно
называть в соответствии с соотношением окислов (М2О:V2O5), из слабощелочных растворов кристаллизуются ванадаты
с соотношением 4:1, 3:1 (называемые также «ортованадатами») и 2:1
(«пированадаты»). Из нейтральных растворов получают «метаванадаты» с
соотношением 1:1 и все они бесцветны. Из кислых растворов кристаллизуются
окрашенные (от оранжево-желтых до оранжево-красных) ванадаты; соотношение М2О:V2O5 в них может меняться от 0,8:1 до 0,25:1 /2/.
При постепенном подкислении раствора
могут существовать следующие формы соединений /2/:
2[VO4 ]3-
+ 2H+ ↔ [V2O7]4- +
H2O (pH – 12-10.6) (1)
2[V2O7]4- +4H+ ↔
[V4O12]4- + 2H2O (pH – 9-8.9) (2)
5[V4O12]4- +8H+ ↔
2[V10O28]6- + 4H2O (pH – 7.0-6.8) (3)
[V10O28]6- +
6H+ ↔ H6[V10O28]
↔ 5V2O5+
3H2O (pH – 1.6) (4)
H6[V10O28]
+ 10H+ ↔
10[VO2+] + 8H2O (pH <1) (5)
Таким
образом, более простые ванадат-ионы склонны переходить, отщепляя воду, в более
сложные ионы. Следовательно, в рассматриваемом случае речь идет о поливанадиевых
кислотах или поливанадат-ионах, различающихся числом входящих в них атомов
ванадия.
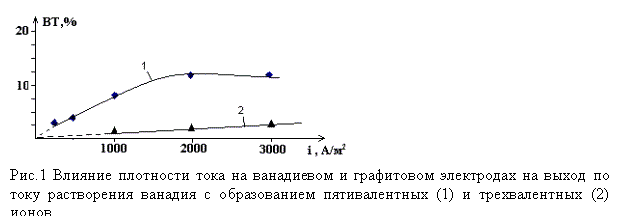 Как показывают результаты исследований в растворах
хлорида натрия при поляризации переменным током ванадий в паре с графитом
электродом при небольших плотностях тока до 1000 А/м2 , ванадий
переходит в раствор в
Как показывают результаты исследований в растворах
хлорида натрия при поляризации переменным током ванадий в паре с графитом
электродом при небольших плотностях тока до 1000 А/м2 , ванадий
переходит в раствор в
виде пятивалентного иона.
С повышением плотности переменного тока до 1000 А/м2
и более, кроме пятивалентного иона на поверхности электрода образуется
коричневый налет (оксид ванадия (ІІІ)). До плотностей тока от 0 до 2000А/м2
, выход по току пятивалентного ванадия возрастает, и в дальнейшем увеличение
тока на выход по току практически не влияет.
При проведении электролиза одновременно велось
осциллографические наблюдения, при этом искажение симметричности синусоиды не
наблюдалось, а напряжение между электродами изменялось от 0,6В (при 250 А/м2) до 3,2В (при 3000 А/м2) (рис.1).
Для сравнения были проведена серия опытов при анодной
поляризации ванадиевых электродов, как видно из табл.1, при одинаковых величинах
токов при поляризации переменным током напряжение между электродами намного
меньше, чем при поляризации постоянным током.
Таблица 1 Влияние величины тока (I) на напряжение между электродами при поляризации
переменным (U~) и постоянным (U-) токами.
|
I, А |
U~, В |
U-, В |
|
0,05 |
0,6 |
5,5 |
|
0,1 |
1,2 |
7,0 |
|
0,2 |
2,1 |
8,0 |
|
0,4 |
3,2 |
-- |
При анодной поляризации постоянным током
ванадий-графит пары электродов выход по току растворения ванадия намного выше
(75-85%), по сравнению с выходом по току при поляризации переменным током.
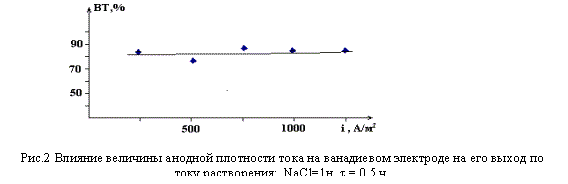
Также нужно отметить, что выход по току не зависит от величины анодной
плотности тока на ванадиевом электроде (рис.2). Результатом электрохимической
реакции является растворение металлического ванадия с образованием
пятивалентных ионов ванадия. При анодной поляризации до плотности тока 500А/м2
ванадий переходит в раствор только в виде пятивалентного иона, а при плотности
тока 500А/м2 параллельно с пятивалентными ионами
в растворе появляется красновато-коричневый студенистый коллоид гидратированной
пятиокиси ванадия V2O5 * nH2O. Согласно литературным данным, гидратированная
пятиокись ванадия очень легко образует коллоидные растворы /3/.
Далее были проведена серия опытов, при поляризации
переменным током ванадий-ванадий пары электродов. Как видно из графика (рис.2),
при небольших плотностях тока выход по току растворения металла совсем небольшой, далее с увеличением плотности тока до 2000А/м2 – выход по
току
пятивалентного ванадия достигает 15% и
параллельно на поверхности электродов образуется трехвалентный ванадий, в виде
оксида темно-коричневого цвета.
Исследования
электрохимического растворения ванадия, когда вторым вспомогательным электродом
служил титан, проводили при аналогичных условиях. Результаты несколько отличаются от предыдущих серий
опытов: до плотности тока 1000А/м2 на ванадиевом электроде
наблюдается постепенное снижению выхода по току образования ванадия (V), а
дальнейшее увеличение плотности тока приводит к резкому повышению его выхода по
току (рис.3), а также совместному образованию ионов трехвалентного ванадия при
величине тока 1000А/м2. Эти отличия можно связать со свойствами
титана при поляризации сразу же смещаться в положительную сторону до величины,
соответствующей какой-то другой возможной электрохимической реакции (4).
Далее
исследовалось влияние исходной концентрации хлорида натрия на выход по току
растворения ванадия (рис.3). При всех концентрациях хлорида натрия ванадий
растворяется с образованием и трех- и пятивалентных ионов. Выход по току
трехвалентного ванадия не зависит от концентрации электролита. Максимальный выход по току растворения ванадия с образованием пятивалентных
ионов наблюдается в 1М растворе хлорида натрия. Дальнейшее увеличение
концентрации хлорида натрия снижает выход по току его растворения и при 4н
растворе NaСl его величина не превышает 2,0 %.
Выход
по току растворения ванадия с
увеличением продолжительности электролиза до 1 часа - увеличивается, а далее
уменьшается. Продолжительность электролиза незначительно влияет на выход по
току образования трехвалентного ванадия (рис.4).
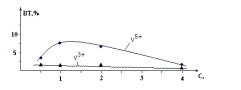
Рис.3
Влияние концентрации хлорида натрия на выхода по току растворения ванадия, при
поляризации ванадий- графит пары электродов переменным током: i = 1000 A/м2, τ = 0.5 час.
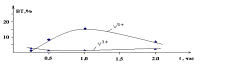
Рис.4 Влияние продолжительности электролиза на
выход по току растворения ванадия, при поляризации ванадий-графит пары
электродов переменным током: NaСl=1н,
i = 1000 A/м2
Далее исследовалось влияние температуры на выход по
току растворения ванадия (рис.5). Повышение температуры раствора ведет к уменьшению выхода
по току растворение ванадия, как до пятивалентных ионов, так и до трехвалентного
оксида.

Рис.5
Влияние температуры электролиза на выход по току растворения ванадия, при
поляризации ванадий-графит пары электродов переменным током: NaСl=1н, i = 1000 A/м2
Таким образом, нами
впервые исследовано электрохимическое поведение ванадия в растворах хлорида натрия при поляризации
промышленным переменным током. Исследовано в какие формы переходит ванадий при
электрорастворении и с каким выходом по току. Показано, что в зависимости от
условий электролиза ванадий растворяется с образованием и трехвалентного оксида
и пятивалентных ионов.