УДК: 543.422.3-76:547.722
А. И.
Панасенко, В. П.
Буряк, И. А. Юрченко,
А. С.
Гоцуля,
В. А. Салионов, Т. А. Самура
Запорожский государственный медицинский университет
УФ-спектрофотометрия
производных фурана (обзор литературы)
Среди соединений, содержащих гетероатом кислорода в
молекуле, один из наиболее важных является фуран, ядро которого составляет
структурную основу многих лекарственных веществ, широко и успешно применяемых в
медицинской практике [9] и пользующихся большим спросом. Все это и определило
интенсивность исследований в области применения УФ-спектроскопии для
производных фурана.
Затруднения в изучении УФ-спектров производных
фурана вызваны определенными разногласиями, которые существуют для настоящего
времени и связаны с электронным строением и химическими свойствами этого ряда
соединений.
Фуран
подобно пирролу и тиофену характеризуется секстетом электронов, образующих
циклическое сопряжение [12], в котором участвуют две p-электрона гетероатома:
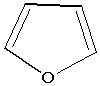 или
или 
Атом кислорода в цикле фурана не имеет вакантных
d-орбиталей. Диеновая
система его отличается малой сопряженностью и в результате альтернирования
зарядов играет роль полупроводника подобно обычной полиеновой цепи [15].
Ультрафиолетовые
спектры соединений фуранового ряда в полярных и неполярных растворителях
характеризируются интенсивной К-полосой и менее интенсивной В-полосой [1]. При
введении электронодонорных или электроноакцепторных заместителей в цикл фурана
полосы поглощения претерпевают сильное батохромное смещение, в результате чего в зоне близкого
ультрафиолета появляется новая полоса высокой интенсивности. В этой же работе
сопоставлены максимумы поглощения 3,3 и 2,2-дифуринов с близкими по строению
тетраенами:
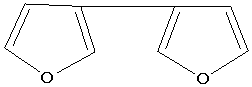 -231 нм
-231 нм 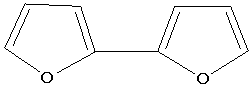 -281 нм
-281 нм
 -223 нм
-223 нм  -304 нм
-304 нм
Близость характеристик этих веществ указывает на
диеновую природу связей фуранового цикла. Однако нужно отметить на довольно
значительное различие между этими данными, что можно объяснить ролью электронов
атома кислорода.
Ряд
авторов [13, 21] на основании данных эксперимента делают вывод, что включение в
цепь заместителя нескольких двойных связей вызывает длинноволновое смещение
К-полосы, столь характерное для полиеновых систем. Для соединений с большим
числом сопряженных этиленовых групп спектральные характеристики имеют близкие
значения. В зависимости от величины индуктивного или мезомерного влияния при
взаимодействии с фурановым циклом заместители дают батохромный сдвиг,
изменяющийся в следующем порядке:
NO2>CHO>COCH3>COOH>CH2OH>CH3
Я. А. Эйдус и соавторы [1] отмечают, что
смещение, вызванное нитрогруппой - сильным
электронно-акцептором - является предельным для системы фурана,
как электронодонора .Это подтверждается тем, что УФ-спектры 5-нитрофурана и 5-нитрофуранкарбоновой кислоты имеют
максимум поглощения в очень узком интервале длин волн (300-310 нм). При
введение в качестве второго заместителя электронодонорной группы (метил- или
амино-) полоса поглощения смещается в сторону длинных волн, что может быть
объяснено трансмиссионной передачей электронной плотности.
Б. Чубар
[18], Н. Н. Борисова, В. Г. Кульневич [2] при изучении влияния растворителя на
спектры поглощения производных фурана установили, что К-полоса этих соединений
претерпевает батохромное смещение по мере увеличения полярности растворителя.
Эти изменения вызваны перераспределением электронов и в принципе подобны
влиянию заместителей.
Характер
спектральных смещений и константы зависимости, определяющиеся
донорно-акцепторной способностью исследуемого заместителя и его партнера,
заместителя в положении 5, изучили Вoig и соавторы [20], Оtt и
соавторы [22]. Это наглядно можно проследить на примере 2-бром- и
2-нитрофуранов. Бром в молекуле 2-бромфурана в возбужденном состоянии является
слабым донором, а нитрогруппа – сильный электороно-акцептор [1,12]. При
исследовании электронных спектров нитрофуранов заметны две зависимости: для
группы акцепторов в положении 5, практически не вызывающих смещений К-полосы, и
для доноров, обусловливающих значительный батохромный сдвиг.
Нитрогруппа вызывает предельно возможную поляризацию
диеновой системы цикла, в результате чего влияние второго электроно-акцептора
сказывается очень мало. При наличии в положении 5 электронно-донорной группы
система получает возможность к трансмиссионному воздействию заместителей, т.е.
создаются благоприятные условия для дополнительной поляризации молекул. Следует
заметить, что 2-бром-производных фурана такого подразделения на два типа
спектральных зависимостей нет, ввиду слабого эффекта, который может оказать
атом брома.
Характер
электроноакцепторной связи в положении 5 определяет способность заместителей
вызывать батохромные смещения К-полосы, возрастающее в следующей
последовательности: CH3-Br-CH2OH-COOH-COOCH3-CHO-NO2. Для
5-электронодонорной группы наблюдаются те же последовательности [19,23].
Производные
5-нитрофуранов приобретают все большее значение в связи с их активным
физиологическим и биологическим действием. Большая роль в развитии химии
нитрофуранов, как лекарственных веществ, принадлежит институту органического
синтеза Академии Наук Латвии [4].
УФ-спектр 5-нитрофурана имеет две широкие полосы
поглощения с максимумом при 226 и 302 нм, причем длинноволновая более
интенсивней коротковолновой [1].
Большой интерес вызывает вопрос о влиянии на
спектр одновременного введения в фурановое кольцо нитрогруппы в положении 5 и
электронно-акцепторной в положении 2. Я.
П. Страдынь и соавторы [16] указывают, что такое взаимное расположение
двух групп в кольце фурана в некотором
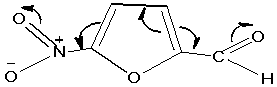
смысле аналогично n-замещению в молекуле бензола. При этом С. А.
Гиллер и Н. О. Салдоболс [3] со всей очевидностью подтвердили тот факт, что при
наличии электронодонорной группы в положении 2, введение нитро-группы в
положение 5 приводит к увеличению батохромного смещения, а не гипсохромного:
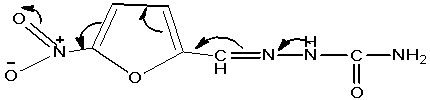
Особый интерес представляют собой гидразоны
производных 5-нитрофуранов, обладающие широким спектром фармакологической
активности, изучению спектров поглощения которых посвящена работа С. А Гиллера
и Я. А. Эйдуса [5]. Соединения этой группы представляют собой сопряженные
системы, в образовании электронных спектров которых принимают участие p-электроны
двойных связей и неподелённой пары электронов азота. Удлинение цепи сопряжения
приводит к батохромному сдвигу полос поглощения по сравнению с
карбонилсодержащими производными фурана. Вероятность получения таутомерного
эффекта можно объяснить смещением электронов по цепи сопряжения в сторону
элекрофильной нитрогруппы, как это видно на примере
5-нитрофурфуролсемикарбазона (фурацилина):
Высокие значения абсорбции лекарственных
средств, производных фурана, позволили исследователям разработать методики
спектрофотометрического количественного определениях их в субстанции и
лекарственных формах.
С.А. Гиллер и соавторы [12] разработали
спектрофотометрический метод определения степени частоты фуразолидона в
присутствии продуктов его полусинтеза , основанный на оценке изменения отношений полученных знаний абсорбции
максимумов к минимумам.
Изучению
зависимости спектров поглощения фурацилина, фуразолидона, фурадонина и
фуразидина от растворителя и
концентрации калия гидроксида посвящена работа В.Э. Эгерта и соавторов [10].
Авторами предложен спектрофотометрический метод идентификации и количественного
определения указанных препаратов в двухкомпонентной смеси без разделения в среде диметилформамида или ацетона в
присутствии раствора калия гидроксида.
С. А.
Гиллер и соавторы [17] разработали методику спектрофотометрического определения
фурагина в 0,5 % водном растворе диметилформамида при 293 и 396 нм. Для
количественного определения фурагина в смеси с фурацилином или фурадонином без
предварительного разделения авторы использовали явление раздвижения максимумов
поглощения соединений нитрофуранового ряда в диметилформамиде или ацетоне в
присутствии небольших количеств щелочи.
Н. В.
Куринная [6,7,8] разработала методику
спектрофотометрического определения фурацилина в субстанции, этанольном
растворе, мази, таблетках; фуразолидона в субстанции и таблетках при 258 нм.
Установлено, что для количественного определения фурадонина и фурагина в
качестве растворителей могут быть использованы вода, 0,01М раствор натрия
гидроксида и 50% сульфатная кислота, а для фурагина дополнительно и
диметилформамид. Предложены методики спектрофотометрического определения
фуразонала в субстанции и таблетках при 239 нм в воде или 238 нм в этаноле.
Разработаны методики спектрофотометрического определения фуразолина в
субстанции и таблетках, а нитрофурилена в субстанции, мази и спиртовом
растворе. Ошибка определения всех анализируемых препаратов не превышала ± 1-2%.
Т. С.
Дмитренко и соавторы [14] разработали методику
спектрофотометрического определения фурацилина и новокаина в коллагеновой губке «колоцил». Относительная
ошибка определения для фурацилина ± 7,6%, для новокаина ± 3,6%, растворитель
0,001 М раствор хлоридной кислоты.
Литература
1. Атлас электронных спектров 5-нитрофурановых
соединений / Я.А. Эйдус, А. Экмане , К. Вентер, С.А. Гиллер.-Рига, Занатне,
1988-256с.
2. Борисова Н.Н. УФ-спектры карбонилсодержащих
фурановых соединений / Н.Н. Борисова, В.Т. Кульневич // Химия гетероцикл.
соединений. -1973-№5.-с.590-594.
3. Гиллер С.А. Некоторые исследования
ультрафиолетовых спектров поглощения нитрофуранов / С.А. Гиллер, Н.О. Салдоболс
// Изв. АН Латвии. сер.физ.-1993.-т.57,№7.-с.708-714.
4. Гиллер С.А. Ультрафиолетовые
спектры
поглощения некоторых нитрофуранов // фурацилин и опыт его
применения.-Рига,1983.-с.75-90
5. Гиллер С.А. Ультрафиолетовые спектры
поглощения некоторых нитрофуранов / С.А. Гиллер, Я.А. Эйдус // Изв. АН Латвии.
-1991.т.89,№8.-с.1223-1238.
6. Курінна Н.В.
Спектрофотометричне визначення похідних 5-нітрофурану. Повід. ІІ. Кількісне
визначення фурадоніну та фурагіну / Н.В. Курінна //
Фармац.журн.-1971.-№1.-с.37-43.
7. Курінна Н.В.
Спектрофотометричне визначення лікарських речовин похідних 5-нітрофурану.
Повід. III. Кількісне визначення
фуразоналу та ніфурону / Н.В. Курінна // Фармац. журн.-1972.-№2.-с.20-25.
8. Курінна Н.В.
Спектрофотометричне визначення похідних 5- нітрофурану. Повід. IV. Кількісне визначення фуразоліну та нітрофурилену / Н.В.
Курінна // Фармац. Журн.-1972.-№4.-с.35-39.
9. Машковский М. Д.
Лекарственные средства. В 2-х томах, 14-е изд. – М.: ООО "Новая
Волна", Издатель С. Б. Дивов, 2002. – т. 1 – 544 с.;
т. 2 – 608 с.
10. Методы количественного определения 5-
нитрофуранов. VII. Спектрофотометрическое определение /В.Э.Эгерт, С.А.
Гиллер, А.А. Лиелгалве, М.В.Шиманская // Изв. АН Латвии.
Сер.хим.-1993-№5-с.531-540.
11. Методы количественного определения
5-нитрофуранов.V. Спектрофотометрическое определение
фуразолидона в присутствии некоторых примесей / С.А. Гиллер, В.Э. Эгерт, М.В.
Шиманская, С.К.Герман // Изв. АН Латвии.-192.-№4.-с.577-581.
12. Несмеянов А.Н. Начало органической хими: В
2-хт. / А.Н. Несмеянов, Н.А. Несмеянов // М.:
Химия,1994-т.1,-623с.;т.2.-744с.
13. Пещехонова А.Д. Ультрафиолетовые спектры
поглощения некоторых 2,5-замещённых фуранов / А.О. Пещехонова, А.А. Пономарев,
М.Д. Липатова // Изв. АНССР. Сер.физ.-1983-Т.47,№1.-с.58-61.
14. Определение новокаина и
фурацилина в многокомпонентной коллагеновой губке / Т. С. Дмитренко, А. В.
Суранова, А. И. Лутцева // Фармация.-1986.-т.35, №3.-с.41-43.
15. Попов Е. М. Строение спряженных углеводородов
с открытыми цепями / Е. М. Попов, Г. А. Коган // Успехи химии.-1998.-Т.67,вык.
2,-с.256-295.
16. Страдыно Я. П. Паляографическое
восстановление производных 2-нитрофурана и 2-нитроселенофена / Я.П. Страдыно,
С. А. Гиллер, Ю. Юрьев // Докл. АН. Латвии. -1999.-т.129,№4.-с.816-819.
17. Химия фурагина и солофура. Аналитическое
определение фурагина и солфура.1: Методы определения фурагина / С.А. Гиллер,
В.Э.Эгерт, М.В. Щиманская // Фурагин и солафур.-Рига,1998.-с.15-26.
18. Чубар Б. Некотрые аспекты роли растворителя
в органической химии / Б. Чубар // Успехи химии -1995-т.64, вып.7.-с.1227-1248.
19. Andrisano R.
Spettri U.V. di alcuni derivati
turandicarbonici / R. Andrisano, A.Tundo // Gazz. Chim. I tal.-1991.-val.121,№4/5.-P.414-418.
20. Boig F.S.
Ultraviolet absorption spektra in the thiophene series:Halogen and nitro
derivatives / F.S.Boig,G.W.Costa,I.Oscar // I.org.chem.-1993-val.58,№7.-p.775-778.
21. Kallinick G.
Uber das spektrale Varhaltenvinylenhomologer Methylturturole / G. Kalinick //
Aech. Pharm.-1991.-Ig. 294/66, №2-S.
90-93.
22. Absorption
and Huorescence spectra of 2.5- diaryloxazoles and related compounds / D.G.Ott,
F.N. Hayes, E. Hansbury, V.N. Kerr // I.Amer. chem.Soc. -1994.-val119,№20.-P.5448-5454.
23. Stutz E.Uber
die Bildung von 5-Formylbenz - cheimsaure aus D- Galacturonsaure / E.Stutz,
H.Deul // Helv.chim.acta.-1996.- vol.79, fasc. 7.- P.2126-2130.