УДК:
615.462-036.5
РАЗРАБОТКА БИОДЕГРАДИРУЕМЫХ МЕМБРАН, ОБЛАДАЮЩИХ
ПРОТИВОВОСПАЛИТЕЛЬНЫМИ СВОЙСТВАМИ,
С ЦЕЛЬЮ ПРОФИЛАКТИКИ ОБРАЗОВАНИЯ СПАЕК ПОСЛЕ
ВНУТРИПОЛОСТНЫХ ОПЕРАЦИЙ
Насонова М.В., Ходыревская Ю.И., Акентьева Т.Н.,
Глушкова Т.В., Кудрявцева Ю.А.
ФГБУ «Научно-исследовательский институт комплексных проблем
сердечно-сосудистых заболеваний» СО РАМН, г. Кемерово, Россия
DEVELOPMENT OF A NOVEL
ANTI-INFLAMMATORY BIODEGRADABLE MEMBRANE TO PREVENT POST-SURGICAL ADHESION FORMATION
Nasonova M.V., Khodyrevskaya Y.I., Akentyeva T.N., Glushkova T. V., Kudryavtseva Y.A.
1Research Institute for Complex Issues of Cardiovascular Diseases,
Kemerovo, Russia
Сведения об авторах:
Насонова
Марина Владимировна, научный сотрудник лаборатории новых биоматериалов ФГБУ
«НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН.
650002,
Россия, г. Кемерово, Сосновый бульвар, 6.
Ходыревская
Юлия Ивановна, младший научный сотрудник лаборатории новых биоматериалов ФГБУ
«НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН.
650002,
Россия, г. Кемерово, Сосновый бульвар, 6.
Акентьева
Татьяна Николаевна, младший научный сотрудник лаборатории новых биоматериалов
ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН.
650002,
Россия, г. Кемерово, Сосновый бульвар, 6.
Глушкова
Татьяна Владимировна, к.б.н., научный сотрудник лаборатории новых биоматериалов
ФГБУ «НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН.
650002,
Россия, г. Кемерово, Сосновый бульвар, 6.
Кудрявцева
Юлия Александровна, д.б.н., заведующая лабораторией новых биоматериалов ФГБУ
«НИИ комплексных проблем сердечно-сосудистых заболеваний» СО РАМН.
650002,
Россия, г. Кемерово, Сосновый бульвар, 6.
Тел.
сот. 8-905-902-61-84, е-mail: kudrua@cardio.kem.ru
РЕЗЮМЕ
Изготовлены
и протестированы противоспаечные мембраны на основе сополимера полигидроксибутировалерата с молекулярной массой 404
кДа. Для придания мембранам противовоспалительных и антиадгезивных свойств использовали дипиридамол с концентрацией 0,5 мг/мл. Образы мембран изготавливали методом
полива на поверхность стекла и методом электроспиннинга.
Для оценки противовоспалительной активности мембраны имплантировали
внутрибрюшинно крысам-самцам линии Wistar. В сыворотке крови животных через 14
дней оценивали количество TNF α, IL 6
и МСР-1. Показано, что метод
электроформования позволяет равномерно распределять лекарственный препарат как
по всему объему матрицы, так и включать во внутреннюю часть формируемых
волокон. Включение дипиридамола во внутреннюю часть волокон способствует его
последующему равномерному выделению в окружающее пространство. Показано, что дипиридамол, выделяясь в окружающие ткани,
оказывает локальный противовоспалительный эффект.
Ключевые слова: спаечный процесс, профилактика
образования спаек, биодеградируемые мембраны, биосовместимые полимеры,
противовоспалительный эффект.
ABSTRACT
We produced and tested anti-adhesion membranes on the basis of
polyhydroxybutylvalerate copolymer with molecular weight 404 kDa. To make membranes
having anti-inflammatory and anti-adhesion properties we used dipyridamole with 0,5 mg/ml concentration.
Images of membranes were produced by casting on a glass surface and by
electrospinning methods. To estimate the anti-inflammatory
activity the membranes were implanted intraperitoneally to male Wistar. In 14
days the amount of TNF α, IL 6 и МСР-1 were estimated
in the blood serum of animals. It was shown that electrospinning method allowed
to equally distribute the medicine both as on the whole volume of a scaffold
and to include into the inner part of the formed fibers. Inclusion of
dipyridamole into the inner part of the fibers contributed to its further equal
release to the surrounding space. It was shown that dipyridamole while
releasing into the surrounding tissues had local anti-inflammatory
effect.
Key
words: adhesion, prevention of adhesion formation, biodegradable membranes,
biocompatible polymers, anti-inflammatory effect.
Во всем мире продолжается совершенствование материалов
для профилактики спаечного процесса после полостных хирургических операций [1].
В кардиохирургии применение
биорезорбируемых мембран позволит значительно снизить риск таких осложнений,
как случайное повреждение структур сердца при диссекции спаек, исключая
дополнительную хирургическую травму и вызывают минимальный воспалительный ответ
со стороны организма [1,2]. Однако, ни одна из предложенных на рынке мембран не
дает 100% эффективности в профилактике образования спаек [3]. Все разработанные
мембраны не учитывают особенности патогенеза образования спаек, и в частности,
воспалительный процесс [4,5]. Разделительные мембраны должны помимо физического
разделения раневых поверхностей, максимально снижать воспалительную реакцию
травмированных тканей и обладать антиадгезивным эффектом, что возможно путем
инкорпорирования в структуру биодеградируемой матрицы лекарственных препаратов
направленного действия. Таким образом, целью настоящего исследования явилась оценка
возможности создания биодеградируемых противоспаечных мембран, обладающих
противовоспалительным и антиадгезивным
эффектами.
МАТЕРИАЛЫ И МЕТОДЫ
Использовали сополимер
полигидроксибутировалерата (ПГБВ) с молекулярной массой 404 кДа (Институт
биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, г. Пущино). Мембраны изготавливали методом полива
на поверхность стекла (3% раствор в хлороформе) и на установке для электроспиннинга Nanon 01А (MECC Inc., Япония), при напряжении 18 Кв,
скорость подачи раствора - 0,4 мл/ч, 8% раствор ПГБВ
в хлороформе. В качестве действующего вещества был выбран дипиридамол (ДП),
поскольку он обладает антиадгезивными, антиагрегантными, ангиопротективными и
иммуномодулирующими свойствами [6], а также имеет ярко желтую окраску раствора,
что позволяет измерять его количество
спектрофотометрическим методом. Базовая концентрация ДП составила 0,5 мг/мл.
Для включения препарата во внутреннюю часть волокна использовали коаксиальную
насадку. В
раствор, содержащий дипиридамол, добавляли флуоресцентную метку Fluorescein
isothiocyanate (Sigma). Структуру волокна изучали при помощи
люминесцентного микроскопа «Axio Imager.A1»
(Carl Zeiss) с использованием
фильтра (495 нм/519 нм). Динамику
выделения дипиридамола оценивали путем инкубации образцов размером 10мм х10 мм
в 0,05М фосфатном буфере рН 7,4 (спектрофотометр Ultraspec Plus, LKB-Pharmacia).
Для оценки противовоспалительной активности,
образцы мембран имплантировали внутрибрюшинно крысам-самцам линии Wistar весом
300-350 г. (n=30). Лабораторным животным под ингаляционным наркозом
изофлурана («E-Z Anestesia»,
E-Z Systems
Corporation) в
условиях чистой операционной проводили срединную лапаротомию, на
париетальную брюшину накладывали мембраны размером 2,0х2,0 см, фиксируя нитью PDS
6/0, после чего брюшину послойно ушивали нитью Лавсан 3/0. Через 14 суток
животные были выведены из эксперимента. В сыворотке крови методом
иммуноферментного анализа оценивали некоторые маркеры воспаления – фактор
некроза опухоли α (TNF α), интерлейкин 6
и моноцитарный хемоаттрактантный белок МСР-1. В качестве контроля исследовали
плазму крови ложнооперированных крыс (срединная лапаротомия, без имплантации
образцов мембран). Данный подход позволяет учитывать реакцию животного на
оперативное вмешательство, и полученные результаты свидетельствуют о
воспалительной реакции именно на имплантацию мембран. Все манипуляции лабораторным животным проводили с соблюдением «Правил
проведения работ с использованием экспериментальных животных», «Правил по
обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных»,
утвержденными Минздрава СССР (1977) и Минздрава РСФСР (1977) и в соответствии с
требованиями приказов №1179 Минздрава СССР от 10.10.1983 г., №267 Минздрава
России от 19.06.2003 г.
Статистическую
обработку полученных результатов проводили с помощью пакета прикладных программ
Statistica 6,0. Рассчитывали
медиану и квартили (Ме (25%;75%)). Для проверки гипотезы о равенстве законов
распределений использовали критерий Манна-Уитни. Статистически значимыми
считались различия при р<0,05. Графически результаты эксперимента
представлены в виде диаграмм со значениями Ме (25%-75%).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Включение лекарственных веществ в состав полимерной
матрицы возможно различными способами, от которых в дальнейшем будет зависеть
скорость их высвобождения. Метод
электроспиннинга позволяет равномерно распределять лекарственное вещество как
по всему объему матрицы, так и включать
во внутреннюю часть формируемого волокна при помощи коаксиальной насадки. Локализацию
дипиридамола в составе волокна оценивали методом флуоресцентной микроскопии.
Доказано, что при использовании коаксиальной насадки дипиридамол содержится
только во внутренней части волокна (рис. 1а), при этом размер самой нити
составляет приблизительно 5,7 мкм, а внутренняя часть - 2,6 мкм (рис. 1б).
|
а |
б |
||||
|
Рис.
1 Волокно, полученное методом
электроспиннинга, содержащее во внутренней фазе дипиридамол: а) общий вид
нити, б) размеры внешней и
внутренней части волокна. |
|||||
Динамику выделения
дипиридамола оценивали как процент выделившегося препарата от исходного
количества в образце (рис. 2). Полученные результаты показывают, что включение
дипиридамола в состав мембраны, изготовленной методом полива, способствует
быстрому выделению препарат в раствор. В течение первых суток инкубации в
буферный раствор вышло 73,5% дипиридамола, к 14 суткам это количество достигло
90%. Таким образом, наблюдали
достаточно быстрые темпы высвобождения
препарата из структуры мембраны.
Включение же дипиридамола в состав волокна в процессе
электроформования позволяет значительно замедлить темпы выделения препарата.
Так, в первые сутки выделилось 37,5% дипиридамола с последующим равномерным
выделением, к 14 суткам это количество достигло 46%.
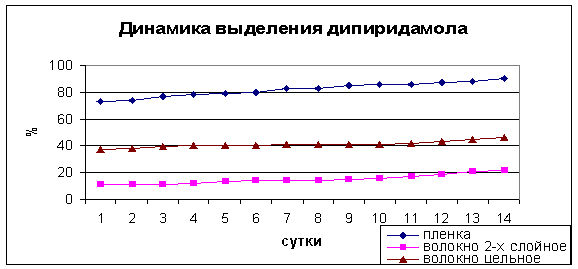
Рис. 2 Динамика выделения дипиридамола из образцов
изготовленных: методом полива (пленка), методом стандартного
электроформования (волокно цельное)
и методом электроформования с
использованием коаксиальной насадки (волокно 2-слойное)
Включение дипиридамола во внутреннюю фазу волокна
позволило в два раза уменьшить количество выделившегося препарата, что к 14
суткам не превышало 21%. Очевидно, что технология изготовления противоспаечной
мембраны, в которой препарат заключен во внутреннюю часть волокна, способствует
его медленному и равномерному выделению в раствор. Поскольку при имплантации в
организм среда, которая будет окружать противоспаечную мембрану, будет более
агрессивная, чем буферный раствор, то и выделение фармпрепарата будет более
интенсивным. В связи с этим, изготовление мембран методом электроспиннинга с
включением лекарственного препарата во внутреннюю часть формируемых волокон
является оптимальным.
Для противоспаечных мембран, помимо разобщения
раневых поверхностей, важны такие качества как биосовместимость и противовоспалительный
эффект после имплантации. Полученные результаты свидетельствуют, что
имплантация мембран с инкорпорированным дипиридамолом, вызывают у лабораторных
животных меньшую воспалительную реакцию, по сравнению образцами без включенного
препарата. TNFα является внеклеточным белком, многофункциональным
провоспалительным цитокином, который синтезирует в основном моноциты и макрофаги. Поскольку при имплантации биоматериала в организм в
первую очередь реагируют макрофаги, то резкое увеличение данного белка
свидетельствует о недостаточной биосовместимости материала. При имплантации
мембран ПГБВ достоверно повышается уровень TNFα (p=0,027),
в тоже время, уровень данного белка в группе животных, которым имплантировали
мембраны ПГБВ+ДП, не имел достоверных отличий от контрольной группы (р=0,62) (рис. 3).
Интерлейкин 6 (IL-6) — интерлейкин, который может действовать как провоспалительный и антивоспалительный цитокин. Синтезируется активированными макрофагами и T-клетками и стимулирует иммунный ответ. Особенно его роль велика при
травматическом поражении ткани, ожогах и других повреждениях, ведущих к
воспалению.
Повышение уровня ИЛ-6 в
крови наблюдается при многих патологических состояниях: тяжёлых воспалительных
процессах, инфекциях, травмах. В группе животных, которым имплантировали мембраны ПГБВ, мы также наблюдали
достоверное повышение IL6 (р=0,014). В группе животных ПГБВ+ДП уровень IL6 незначительно превышал значения
контрольной группы (р=0,14).
* *
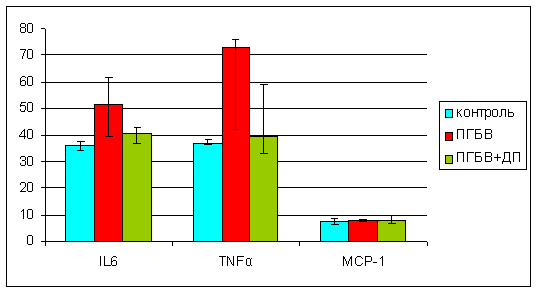
Рис.
3 Показатели маркеров воспаления в сыворотке крыс: контрольной группы; ПГБВ –
мембрана на основе ПГБВ, изготовленная путем электроспиннинга; ПГБВ+ДП –
мембрана на основе ПГБВ с инкорпорированным внутрь дипиридамолом.
*
- р<0,05 по сравнению с контролем.
О развитии воспалительной реакции
свидетельствует также и уровень моноцитарного хемоаттрактантного белка МСР-1. В
исследуемых группах животных достоверных различий не было, однако при
имплантации мембран ПГБВ и ПГБВ+ДП наблюдали тенденцию к повышению данного
протеина 7,72 мкг/мл (7,56-8,03) и 7,82 мкг/мл (6,75-9,96) соответственно
против 7,29 мкг/мл (6,35-8,59) в контрольной группе. В целом, уровень данного
протеина свидетельствует о минимальной воспалительной реакции на имплантацию
мембран ПГБВ и ПГБВ+ ДП.
Таким образом, на
основании полученных результатов имплантации различных мембран лабораторным крысам, можно сделать
предварительный вывод о том, что имплантация мембран на основе
полигидроксибутирата/оксивалерата вызывает умеренную воспалительную реакцию.
Включение в состав мембраны дипиридамола существенно снижает ответную реакцию
организма, что позволяет также делать
вывод о том, что лекарственный препарат, выделяясь в окружающие ткани,
оказывает локальный противовоспалительный эффект. Полученные результаты
свидетельствуют о высоких биосовместимых свойствах разрабатываемых мембран.
Список использованной литературы
1. Kaneko Y., Hirata Y., Achiwa I. et al. Adhesion barrier reduces postoperative adhesions after cardiac surgery
//Asian Cardiovasc. Thorac. Ann. 2012; 20:257-262.
2.
Worldwide market for surgical sealants, glues, wound closure and anti-adhesion,
2012-2017 // A Worldwide Business Report from MedMarket Diligence , 2012.
3. Moralesa D., Williamsb E., Johnc R. Is resternotomy in cardiac surgery still a problem? // J. Interact CardioVasc
Thorac Surg. 2010; 11(3):277-286.
4. Walther T.,
Rastan A., Dähnert I. et al. A novel adhesion barrier
facilitates reoperations in complex congenital cardiac surgery // J. Thorac
Cardiovasc Surg. 2005; 129: 359–363.
5. Lalountas M.,
Ballas K.D., Michalakis A., et al. Postoperative adhesion prevention using a statin-containing cellulose
film in an experimental model // Br J Surg. 2012;
99(3):423-429.
6.
Дипиридамол (Курантил). http://doctorspb.ru/articles.php?article_id=1646

