Физика
/1.Теоретическая физика
К.п.н.
Мищик С.А.
Государственный
морской университет имени адмирала Ф.Ф.Ушакова ,
Россия
Системные задачи электропроводности жидкости
прикладной физики морского флота
Системные
задачи электропроводности жидкости прикладной физики морского флота отражают
целостно-системное моделирование основных элементов транспортных объектов. При
этом возникает ориентация на единство базисных характеристик предметных и
исполнительных условий относительно предмета содержания и способа его реализации.
Рассматриваются: определение сопротивления морской воды, скорость движения ионов в электролите судового
аккумулятора, условия эффективной зарядки и
эксплуатации судовых аккумуляторов, причины
возрастания плотности электролита судового кислотного аккумулятора, определение
удельной электропроводности абсолютно чистой воды на морском флоте.
В
процессе решения системных задач электропроводности жидкости прикладной физики
морского флота необходимо применять основные положения теории деятельности, системного
анализа и теории формирования интеллекта.
Системный
анализ предполагает выполнение последовательности системных аналитических действий:
выделить объект анализа –задачу электропроводности жидкости прикладной физики
морского флота (ЗЭЖПФМФ) как систему; установить порождающую среду ЗЭЖПФМФ;
определить уровни анализа ЗЭЖПФМФ; представить целостные свойства ЗЭЖПФМФ
относительно пространственных, и временных характеристик и их комбинаций;
выделить структуру уровня анализа ЗЭЖПФМФ; установить структурные элементы
уровня анализа ЗЭЖПФМФ; определить системообразующие связи данного уровня
анализа ЗЭЖПФМФ; представить межуровневые связи анализа ЗЭЖПФМФ; выделить форму
организации ЗЭЖПФМФ; установить системные свойства и поведение ЗЭЖПФМФ.
Задача 1
Два электрода-зонда судовой системы автоматического
контроля в виде металлических шаров диаметром d = 30 см
находятся в море на изолированных кабелях
на глубине h = 60 м.
Расстояние между электродами-зондами судовой системы автоматического контроля ℓ = 300 м. Удельная проводимость
морской воды λ = 4 См/м. Определите сопротивление морской воды между электродами-зондами
судовой системы автоматического контроля.
Ответ: R = 0,14 Ом
Задача 2
Определить скорость движения ионов в электролите
судового аккумулятора, если концентрация ионов в электролите судового аккумулятора равна n = 1022
см-3, площадь каждого электрода судового аккумулятора S = 50 см2
и сила тока в судовой электрической цепи равна I = 1 Ампер.
Ответ: υ = 0,00013 мм/с.
Задача 3
Определить силу тока, проходящего через раствор
электролита судового газоанализатора, если за t = 1 минуту
разлагается m = 1 грамм
воды. Определить объём гремучего газа, который выделяется в судовом
газоанализаторе при нормальных условиях.
Ответ:
![]() .
.
Задача 4
Определить количество
электроэнергии необходимой для получения в судовом газоанализаторе водорода
объёмом V = 2,5 литра
при температуре t = 250С и давлении P = 105 Паскалей, если электролиз ведётся
при напряжении U = 5 Вольт, а коэффициент полезного действия судового газоанализатора равен η
= 75%.
Ответ:![]() .
.
Задача 5
Определить Э.Д.С. ε элемента
судового аккумулятора, если при соединении одного грамм-эквивалента цинка с
серной кислотой выделяется Q1 = 124
ккал тепла, а для выделения одного грамм-эквивалента меди из CuSO4 необходимо
затратить Q2 =99,7
ккал энергии.
Ответ: Э.Д.С. ε = 1,06 В.
Задача 6
При зарядке судового кислотного аккумулятора плотность
электролита увеличивается от ρ1 = 1,1
г/см3 до ρ2 = 1,3
г/см3. Объяснить причину возрастания плотности электролита судового
кислотного аккумулятора.
Ответ: причины возрастания плотности
представляются уравнением
![]() . Плотность электролита возрастает за счёт Н2SO4 .
. Плотность электролита возрастает за счёт Н2SO4 .
Задача 7
Две вертикально расположенные параллельные пластины плоского датчика-конденсатора судовой системы автоматического управления касаются поверхности контрольной жидкости. Размеры пластин a и b, расстояние между ними d . Пластины плоского датчика-конденсатора судовой системы автоматического управления заряжены до разности потенциалов φ0 и отключены от источника судового электропитания. Определить высоту подъёма контрольной жидкости.
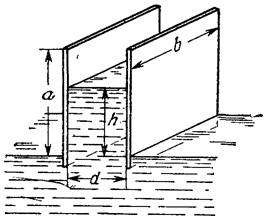 Ответ:
Ответ:![]() .
.
Задача 8
Две вертикально расположенные параллельные пластины плоского датчика-конденсатора судовой системы автоматического управления касаются поверхности контрольной жидкости. Размеры пластин a и b, расстояние между ними d . Пластины плоского датчика-конденсатора судовой системы автоматического управления заряжены до разности потенциалов φ0 и постоянно подключены к источнику судового электропитания. Определить высоту подъёма контрольной жидкости.
Ответ:![]() .
.
Задача 9
Определить расход цинка в судовом электрическом аккумуляторе
за t =20 минут
работы при токе нагрузки I = 0,5 Ампер. Валентность цинка равна n=2.
Принять, что «выход» тока судового электрического аккумулятора равен η=100% .
Ответ: m = 0,203 грамма.
Задача 10
Для контроля качества работы судовой опреснительной
установки определить удельную электропроводность абсолютно чистой воды при t0C =250C. Ионное произведение воды при t0C
=250C равно 1,00.10-14,
то есть K·[H2O] = Kв = 1,8·10−16 моль/л·55,56
моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25
°C).
Ответ: λ
= 5.5×10 –6 См· м –1
Задача 11
В судовой системе электронного контроля определить
скорость движения иона Na+ в водном растворе при t0C
=250C, если разность
потенциалов на электродах контрольного судового устройства равна Δφ
=10 В. Электроды контрольного судового устройства находятся в водном
растворе на расстоянии d =1 см друг от друга. Определить время движения иона Na+
между электродами контрольного судового устройства
Ответ: υ
=5,2 · 10 –5
м/с ; t = 193 с.
Задача 12
Для судовой системы электронного контроля определить удельную
электропроводность λ морской воды (водного раствора NaCl) объёмом V =1
литр при температуре t0C =250C считая, что подвижности ионов при этой концентрации
равны их предельным подвижностям. Определить расстояние, пройденное ионами Na+
и Cl-
за время t = 10 минут
в судовой системе электронного контроля, если через слой раствора длиной ℓ
=1 см, заключенный между датчиками-электродами судовой системе
электронного контроля площадью S =1 см2, пропускают ток силой I =1 мА.
Ответ: λ
= 0,1264 См·м –1 ; ℓ
(Na + ) = 2,46 мм; ℓ (Cl – ) = 3,75
мм.
Задача 13
Для судовой системы электронного контроля определить
эффективный радиус r иона Li+ при температуре t0C =250C из его предельной подвижности, используя закон
Стокса. Определить приблизительное число n молекул воды, входящих в
гидратную оболочку иона Li+. Кристаллографический радиус
иона Li+
равен r = 60 пм. Вязкость воды при температуре t0C =250C равна η = 8,91·10-4 Па·с.
Собственный объем молекулы воды оценить из параметров уравнения Ван-дер-Ваальса.
Ответ: r
= 2,5 А0; n (H2O) = 5.
Задача 14
Удельная электропроводность водного раствора сильного
электролита судовой системы электронного контроля при температуре t0C=250C равна λ1=109,9 См·см2·моль–1
при концентрации n1 = 6,2·10-3 моль·л-1 и λ2 =106,1 См·см2·моль–1
при концентрации n2 =
1,5·10-2 моль·л-1. Определить
удельную электропроводность раствора судовой системы электронного контроля при
бесконечном разбавлении раствора электролита.
Ответ: λ = 116,7 См·см2·моль–1
.
Задача 15
Для судового гальванического элемента определить изменение
энтальпии ΔН и количество теплоты q, выделяющейся в судовом
гальваническом элементе при обратимом протекании в водном растворе реакции CuS04 + Zn=Cu + ZnS04
, если при температуре Т1 = 273 К, э.д.с. ε1 =
1,0960 В, а при Т2
= 276 К, э.д.с. ε2 = 1,0961 В.
Ответ: ΔН
= - 2,1·108 Дж;
q =1,755·106
Дж/кг-экв.
Задача 16
Плотность раствора серной кислоты в заряженном судовом
элементе свинцового аккумулятора dз =
1,28 г/см3
(концентрация 36,87% по массе), в разряженном судовом элементе свинцового
аккумулятора dр =
1,10 г/см3
(концентрация 14,35% по массе). Определить количество электролита необходимое
для заливки полностью разряженного элемента судового свинцового
аккумулятора с фактической ёмкостью Qфакт = 120 А·час, чтобы изменение плотности его электролита в процессе
заряда-разряда находилось в указанных пределах. Определить коэффициент
использования H2SO4
.
Ответ: V = 1240 мл; Кисп
= 69,2 %.
Задача 17
Определить объём электролита для последовательно
соединённой судовой аккумуляторной батареи номинальной ёмкостью Q = 1,5 А·час, состоящей из n = 102 элементов, если «полезный» коэффициент использования кислоты в судовой
аккумуляторной батареи равен Кисп
= 55 %. Начальная концентрация H2SO4 C=392 г/л
, электрохимический эквивалент H2SO4 q = 2,20 г/
А·час
.
Ответ: V = 1560 мл .