Сураганова
Д.А., Турпанова Р.М.
Евразийский национальный университет имени Л.Н. Гумилева, г. Астана
ПОЛУЧЕНИЕ
ВЕКТОРА ДЛЯ ЭКСПРЕССИИ РЕКОМБИНАНТНОГО сосудистого
эндотелиального фактора роста В КЛЕТКАХ E.COLI
В
1983 году Сенгером был открыт в клеточной линии карциномы фактор сосудистой
проницаемости эндотелиальных клеток, особенно, им оказалась богата асцидная
жидкость опухоли [1]. Поэтому он получил название сосудистый фактор
проницаемости (VPF).
Другими исследователями был охарактеризован фактор ответственный за ангиогенез
получивший название VEGF.
В последствии было установлено, что VEGF и VPF
идентичны. VEGF
является мультифункциональной молекулой, обладающей разнообразным спектром
биологической активности зависящей от стадии развития и физиологической функции
органа в котором он экспрессируется [2].
VEGF
(vascular endothelial growth factor) - cосудистый эндотелиальный фактор
роста - семейство структурно близких между собой белков:VEGF-A, -B, -C, -D, -E и плацентарного ростового фактора
(placenta
growth
factor,
PlGF)
[3]. Эти биологически активные белки влияют на развитие кровеносных сосудов и
обладают общей структурной архитектурой, несмотря на малую степень гомологии
первичных последовательностей. Они имеют общую структуру цистеинового узла [4].
VEGF-А
является наиболее мощным и основным регулятором ангиогенеза и васкулогенеза.VEGF-А, высоко специфичным митогеном
для сосудистых эндотелиальных клеток, способствующий высвобождению белков из
кровеносных сосудов, ассоциированных с опухолью.
VEGF-А
существует в восьми изоморфных формах:VEGF121, VEGF145,
VEGF148, VEGF165, VEGF183,
VEGF189,
VEGF206,
образуемых в результате альтернативного сплайсинга мРНК, которая состоит из
8-ми экзонов. Эти изоформы отличаются в способности связывать гепарин- и
гепаран-сульфат.
Изоформа
VEGF165
была первой идентифицированным членом семейства васкулярных эндотелиальных
факторов роста. VEGF165
является основным сосудистым эндотелиальным фактором роста в человеческих тканях.
VEGF165
транскрибируется в виде 191 членного полипептида, но затем сигнальные 25 первых
аминокислотных остатка специфически отщепляются протеиназой. Зрелый белок
состоит из 165 аминокислотных остатка первые 115 участвуют в образовании
цистеинового узла и ответственны за связывание с рецептором. С концевые 25
аминокислотных остатка не участвуют в рецепторном взаимодействии, а несут сайты
аффиности к гепарину [5].
Аминокислотная последовательность был взята из
статьи Ferrara N, Gerber HP, LeCouter J.
The biology of VEGF and its
receptors. Nat Med. 2003 Jun;9(6):669-76. [37]. Последовательность
представлена на рис.8.
Оптимизация
кодонов последовательности гена VEGF
165 для эффективной прокариотическиой экспрессии была проведена в соответствии
с данными, представленными в базе данных "Codon-Usage Database" для Escherichia coli [http://www.kazusa.or.jp/codon/]
Синтез искусственного гена VEGF165 осуществляли химико-ферментативным способом из перекрывающихся
олигонуклеотидов, составляющих структуру цепей полинуклеотидного дуплекса. Ниже
приведена схема расположения и нумерация олигонуклеотидов (Рис.1).

Рис.1 Схема синтеза искусственного гена VEGF165
Предварительно
нами было проведено ферментативное фосфорилирование полинуклеотидкиназой фага
Т4 олигонуклеотидов за исключением концевых V-1
и V-15.
Последующим отжигом и лигированием ДНК-лигазой фага Т4 олигонуклеотидов (V-1 – V-28), получили искусственный ген VEGF165.
Амплификацию
лигазной смеси проводили при помощи полимеразной цепной реакции (ПЦР) с
праймерами PR-1
и PR-2,
содержащими сайты рестриктаз NcoI
и XhoI
соответственно. Очистка ПЦР-продукта осуществлялась с помощью набора MinElute
PCR Purification Kit (QIAGEN, #27106) (Рис 2).
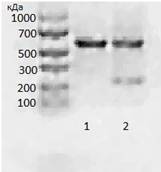
Рис.
2. Электрофореграмма продуктов ПЦР. Дорожка №1 t отжига праймеров 60оC Дорожка
№2 t
отжига праймеров 58оC
В качестве экспрессионного вектора был выбран
плазмидный вектор pET-23d(+). Данный вектор содержит в полилинкерной
последовательности сайты рестрикции NcoI
(ccatgg) и XhoI (ctcgag), по которым и была произведена вставка
амплифицированного гена VEGF165 с учетом корректной рамки считывания (Рис.3)
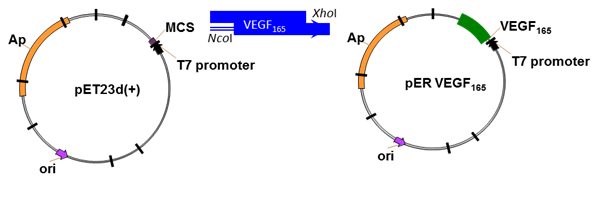
Рис.3 а) Схема получения плазмиды pER VEGF165; б)
Полилинкерная последовательность плазмиды pET23d(+)
После
расщепления эндонуклеазами рестрикции NcoI и XhoI вектор лигировали с очищенным продуктом ПЦР,
обработанным теми же рестриктазами. В результате чего была получена
рекомбинантная плазмида pER VEGF165.
Полученной
лигазной смесью трансформировали компетентные клетки Е.coli ER2566. Суспензию трансформированных клеток
рассевали на чашки с селективной средой. Клоны, полученные при высевании
трансформированных клеток на агаризованную среду с добавлением ампициллина,
пересевали в жидкую среду с добавлением ампициллина для выращивания и отбора
рекомбинантов.
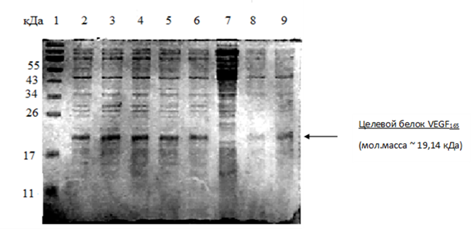
Отбор
рекомбинантов осуществляли по результатам электрофореза клеточных лизатов
клонов в ПААГ представленного на рис. 12.
Рис.12
Электрофореграмма суммарных клеточных лизатов различных клонов. Номер дорожки
на геле соответствует номеру клона. №1- маркер масс.
Для
последующей работы были отобраны клоны №2, №3, №4. Выделение плазмиды для
последующей трансформации компетентных клеток E.сoli ER2566 осуществлялось из отобранных клонов с
помощью набора Promega (по протоколу производителя). Для подтверждения строения вставки гена
рекомбинантного белка, полученные плазмиды были просеквенированы по методу
Сенгера (в компании Евроген). Анализ нуклеотидной последовательности плазмиды pER VEGF165
подтвердил правильность вставки гена VEGF165.
В результате проведенной работы был
осуществлен химико-ферментативный синтез гена белка VEGF165,
и клонирование его в экспрессирующий вектор pET23d(+). Получен высокоэффективный
штамм-продуцент E.coli
(ER2566)/pERVEGF165,
продуцирующий рекомбинантный сосудистый эндотелиальный фактор роста.
Литература
1.
Senger,
D. R., Galli, S. J., Dvorak, A. M., Perruzzi, C. A., Harvey, V. S., and Dvorak,
H. F. Tumor cells secrete a vascular
permeability factor that promotes accumulation of ascites fluid. Science. 1983, 219: 983–985
2.
Grunewald
M, Avraham I, Dor Y, Bachar-Lustig E, Itin A, Yung S, Chimenti S, Landsman L,
Abramovitch R, Keshet E. VEGF-induced adult neovascularization: recruitment,
retention, and role of accessory cells. Cell. 2006, 124(1): 175–189.
3.
Otrock,
Z. K., Makarem, J. A., and Shamseddine, A. I. Vascular endothelial growth
factor family of ligands and receptors: review. Blood Cells Mol. Dis. 2007, 38:
258–268.
4.
Shalini
Iyer and K. Ravi Acharya. Tying the knot. The cystine signature and molecular-recognition
processes of the vascular endothelial growth factor family of angiogenic
cytokines. FEBS Journal. 2011, 278: 4304–4322.
5.
Ferrara
N. Binding to the extracellular matrix and proteolytic processing: two key
mechanisms regulating vascular endothelial growth factor action, Mol. Biol.
Cell. 2010, 21: 687–690.