Сураганова
Д.А., Турпанова Р.М.
Евразийский национальный университет имени Л.Н. Гумилева, г. Астана
Выбор оптимального способа рефолдинга рекомбинантного
сосудистого эндотелиального фактора Роста Vegf 165b полученного из
телец включения
Изоформа
VEGF165 была первым идентифицированным членом семейства васкулярных
эндотелиальных факторов роста. VEGF165 является основным сосудистым
эндотелиальным фактором роста в человеческих тканях. VEGF165 транскрибируется в
виде 191 членного полипептида, но затем сигнальные 25 первых аминокислотных
остатков специфически отщепляются протеиназой. Зрелый белок состоит из 165
аминокислотных остатков, первые 115 участвуют в образовании цистеинового узла и
ответственны за связывание с рецептором. С-концевых 25 аминокислотных остатков
не участвуют в рецепторном взаимодействии, а несут сайты аффиности к гепарину
[1].
Биологически
активной формой данного белка является гомодимер, каждых мономер имеет один
сайт гликозилирования (Asn 75) с молекулярной массой 19165 Да, pI 7,429,
образован семью β-складчатыми листами, и двумя α-спиралями,
соединенных тремя дисульфидными мостиками [2].
Необычная структура внутримолекулярных
цистеиновых мостиков получила название мотив «Цистеиновый узел» [3].
При расщеплении VEGF165 плазмином образуются
два ранее описанных домена: амино-терминальный рецептор связывающий домен
(1-110 аминокислотных остатка) и С-концевой гепарин связывающий домен [4,5].
Биологически активный VEGF 165b имеет в молекуле три
внутримолекулярных дисульфидных мостика, которые образуют так называемый
цитеиновый узел. Также биологически активная форма белка представлена в виде гомодимера
с двумя дисульфидными мостиками. После извлечения рекомбинантного белка из
телец включения необходимо осуществить контролируемое окисление сульфгидрильных
групп с целью восстановления дисульфидных связей. В качестве окислителей в
белковой химии нашли применение окислительно-восстановительные пары окисленный
глутатион/восстановленный глутатион и цистеин/цистин. Также используются в
качестве окислителей ионы двухвалентной меди (медный купорос) и разбавленная перекись
водорода. Использование для окислительного рефолдинга
окислительно-восстановительных пар нежелательно из-за наличия в молекуле VEGF
165b свободной сульфгидрильной группы у цистеинового остатка Cys18.
Применение окисленного глутатиона или цистина сильно удорожает процесс и может
приводить к образованию дисульфидного аддукта белка с окислителем. Поэтому мы
использовали в качестве окислителей медный купорос и пероксид водорода. В
качестве экспресс-критерия правильности рефолдинга использовали растворимость
белка, определяемую фотометрически, на длине волны 600 нм. Реакцию окисления
ионами двухвалентной меди проводили в течение 16-18 ч, при этом каждые 3 ч
измеряли оптическую плотность раствора. Окисление пероксидом водорода протекало
гораздо быстрее, однако выход целевого белка оказался существенно ниже по
сравнению с окислением двухвалентной медью. В присутствии перекиси водорода
содержание растворимого белка снизилось в 3,8 раз, тогда как при использовании
ионов меди не более 5% белка от начального содержания выпадало из раствора в
виде осадка. Правильность образования дисульфидных связей проверяли с помощью
ВЭЖХ. В качестве стандарта использовали стандартный образец VEGF 165b PHC2031 (LifeTechnologies). Хроматограммы ВЭЖХ
стандартного образца, а также VEGF 165b до окисления и препарата VEGF 165b
после окислительного рефолдинга представлены на рисунках 1-3.
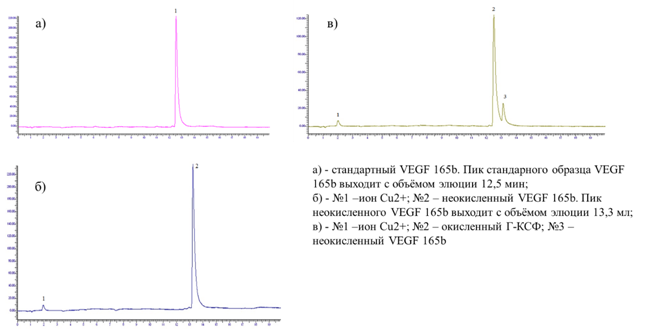
Таким
образом, оптимальным способом образование внутримолекулярных сульфогидрильных
связей в молекуле рекомбинантного VEGF 165b является окисление кислородом
воздуха в присутствие ионов двухвалентной меди.
Заключение
В
ходе проведенной работы был установлен оптимальный способ окислительного
рефолдинга молекул сосудистого эндотелиального фактора роста, заключающийся в
использовании в качестве катализатора следовых количеств ионов двухвалентной
меди. В качестве метода контроля использовали сравнение профилей ВЭЖХ. В
продукте после продолжительной агитации в присутствие ионов меди и кислорода
воздуха регистрировалось значительное накопление окисленной формы белка при
отсутствии помутнения и опалесценции, что свидетельствовало о правильности
образования третичной структуры рекомбинантного полипептида.
Литература
1.
Ferrara
N. Binding to the extracellular matrix and proteolytic processing: two key
mechanisms regulating vascular endothelial growth factor action, Mol. Biol.
Cell. 2010, 21: 687–690.
2.
Muller
YA, Christinger HW, Keyt BA, de Vos AM. The crystal structure of vascular
endothelial growth factor (VEGF) refined to 1.93 A resolution: multiple copy
flexibility and receptor binding. Structure. 1997, 15;5(10): 1325-38
3.
Shalini
Iyer and K. Ravi Acharya. Tying the knot. The cystine signature and
molecular-recognition processes of the vascular endothelial growth factor
family of angiogenic cytokines. FEBS Journal. 2011, 278: 4304–4322.
4.
Wiesmann
C., Fuh G., Christinger H.W., Eigenbrot C., Wells J.A., de Vos A.M. Crystal
structure at 1.7 Å resolution of VEGF in complex with domain 2 of the
Flt-1 receptor. Cell. 1997, 91: 695–704.
5.
Keck
R.G., Berleau L., Harris R., Keyt B.A. Disulfide structure of the heparin
binding domain in vascular endothelial growth factor: characterization of
posttranslational modifications in VEGF. Arch. Biochem. Biophys. 1997,
344: 103–113.