Биологические науки/6. Микробиология
К.б.н.
Додонова А.Ш., Кабдеш И.М.
Карагандинский
государственный университет им. академика Е.А. Букетова, Казахстан
Энтомопатогенные
свойства Bacillus
thuringiensis
Многие виды насекомых, как известно, являются вредителями
растений, паразитами и переносчиками возбудителей болезней человека, полезных
животных и растений. Изобретены самые разные способы и средства истребления
насекомых и защиты от них человека, животных и растений. До последнего времени
наиболее распространенным был химический метод борьбы с насекомыми. Но этот
метод при высокой эффективности имеет три основных недостатка: во-первых,
химические инсектициды в большинстве своем универсальны и убивают не только
вредных, но и полезных насекомых (опылителей, энтомофагов); во-вторых, они
загрязняют окружающую среду; в-третьих, за многолетнюю практику применения
инсектицидов многие виды насекомых приобрели устойчивость к ним (примерно 260
видов вредителей сельского и лесного хозяйства и 170 видов паразитов человека и
сельскохозяйственных животных). Все это вынудило пересмотреть практику
использования химических инсектицидов и по-новому оценить химический метод
контроля. Сейчас наиболее перспективным считается экологический подход,
предусматривающий рациональное сочетание современных защитных приемов и
биометода, в частности, использования энтомопатогенных бактерий как
естественных паразитов насекомых. [1]
Энтомопатогенные бактерии, представляющие интерес для
биологической защиты растений, относятся к трем семействам порядка эубактерий (Eubacteriales): Pseudomonadales, Enterobacteriales
и Bacillales.
Bacillus thuringiensis (Bt) — наиболее распространенный вид энтомопатогенных бактерий.
На основе разных подвидов создана серия биопрепаратов для защиты растений. В отличие
от других видов рода Bacillus эта бактерия образует кристаллы. Впервые она была выделена
Луи Пастером из гусениц тутового шелкопряда в конце XIX в., но идентифицирована
германским ученым Берлинером из Тюрингии в 1911 г. Встречается повсеместно в почве,
на поверхности листьев, в телах насекомых [2].
Bacillus thuringiensis - энтомопатогенный аэробный почвенный
грамположительный микроорганизм, обладающий способностью в ходе споруляции
образовывать кристаллоподобные включения, состоящие из энтомоцидных белков –
эндотоксинов (также называемых Cry-белками) [5]. Хемоорганогетеротроф, факультативный анаэроб. Подвижны, образуют термоустойчивую спору, расположенную
субтерминально. В центре клетки располагается кристалл токсина. Кристаллы имеют
бипирамидальную, кубическую или округлую форму и расположены в спорангии на
противоположном по отношению к споре конце клетки [3].
Предложено различать Bt по серовариантам, биовариантам, фаговариантам,
патовариантам, т. е. по антигенным и биохимическим свойствам, чувствительности
к фагам, и патогенности для насекомых соответственно. В настоящее время для
идентификации Bt используют молекулярно-биологические методы, такие как
полимеразная цепная реакция (ПЦР). Для биозащиты важно разделение на
патоварианты, из которых наибольшее значение имеют три: А, В и С. Патовариант А включает подвиды Bt, патогенные для отрядов Lepidoptera, В — для Diptera, С — для Coleoptera.
К метаболитам Bt относят ферменты, антибиотики
и токсины [2]. Среди этих токсичных продуктов выделяют 4 компонента:
-
α-экзотоксин, или фосфолипаза С, - продукт растущих клеток бактерий.
Токсическое действие фермента связывают с индуцируемым им распадом незаменимых
фосфолипидов в ткани насекомого, что приводит к гибели последнего.
-
β-экзотоксин - накапливается в культуральной жидкости при росте клеток.
Считают, что молекула β-токсина состоит из нуклеотида, связанного через
рибозу и глюкозу с аллослизевой кислотой. Его действие, видимо, обусловлено
ингибированием нуклеотидазы и ДНК-зависимой РНК-полимеразы, связанных с АТФ,
что приводит к прекращению синтеза РНК. По сравнению с другими токсинами
действует медленнее, в основном при переходе от одного цикла развития к
другому. По наблюдениям, β-экзотоксин - мутаген, поражающий генетический
аппарат особей.
-
γ-экзотоксин - малоизученный компонент, неидентифицированный фермент (или
группа ферментов).
-
δ-эндотоксин - параспоральный кристаллический эндотоксин. Образуется в
процессе споруляции бактерии в противоположной от формирующейся споры части
бактерии. На завершающей стадии спорообразования токсин приобретает форму
8-гранного кристалла. Кристаллы состоят из белка, аминокислотный состав
которого близок для различных штаммов. Различие в восприимчивости некоторых
видов насекомых к действию кристалла, по-видимому, связано с присутствием
специальных кишечных протеаз, осуществляющих гидролиз кристаллов in vivo. Такими протеазами обладают не
все насекомые, отсюда и избирательность действия δ-токсина. Чтобы
насекомое погибло, кристаллы должны попасть в его организм. После поглощения
кристаллов гусеницы перестают питаться. Первичным местом действия
δ-токсина является средний отдел кишечника [4]. Белковые кристаллы эндотоксина образуются
одновременно со спорами по одному, реже по два в каждой бактериальной клетке.
Основной
вклад в развитие инфекционного процесса при заражении Bt вносит белковый
кристаллический δ-эндотоксин. У разных подвидов бактерий кристаллы
отличаются по форме и размерам. Так, у бактерий подвида kurstaki кристаллы
бипирамидальной формы, israelensis — округлые, a tenebrionis
— квадратные. Кристаллический эндотоксин
слабоустойчив к действию температуры, нерастворим в
воде и органических растворителях, однако легко
растворяется до протоксина в слабощелочной среде [2].
В настоящее время описано более 60 подвидов Bt.
Продуцируемые ими токсины различаются по специфичности энтомоцидного действия.
Известны токсины, с высокой специфичностью убивающие отдельных представителей
отрядов Lepidoptera (семейства
Cry1 и Cry9), Coleoptera (семейство Cry3) и Diptera (семейства
Cry4 и Cry11) на стадии личинки. Эндотоксины Cry2 обладают двойной
специфичностью – для Lepidoptera и Diptera.
Большинство энтомоцидных
белков имеют молекулярную массу 130-145 kDa (представители семейств Cry1, Cry4,
Cry9 и др.). Попадая в кишечник насекомых, они подвергаются действию
присутствующих там протеиназ, образуя устойчивые к дальнейшему протеолизу
фрагменты 60-70 kDa - так называемые "истинные токсины". Для этих
белков показана четко выраженная доменная структура. С-концевой район
достаточно консервативен среди разных классов энтомоцидных белков. При
протеолизе он легко деградирует путём отщепления небольших фрагментов с молекулярной
массой 15-35 kDa, в свою очередь быстро подвергающихся дальнейшему гидролизу.
N-концевой район (соответствующий "истинному токсину") относительно
устойчив к протеолизу и гораздо более вариабелен у разных белков, нежели
С-концевой район. Таким образом, исходные 130-145 kDa белки представляют собой
протоксины, нуждающиеся в активации протеиназами кишечного сока насекомых.
Группа токсинов, к которой
принадлежат представители семейств Cry2, Cry3, Cry10 и Cry11, включает в себя
белки с молекулярной массой 60-70 kDa. По первичной структуре они напоминают
N-концевые участки ("истинные токсины") 130-145 kDa белков [5].
Механизм
действия эндотоксинов Bacillus thuringiensis.
При попадании в кишечник
насекомого белковый кристалл растворяется в щелочной среде кишечного сока (рН
9.5-10.5); растворенные протоксины активируются протеолитическими трипсино- и
химотрипсиноподобными ферментами кишечника до "истинных токсинов"
(рис.1).
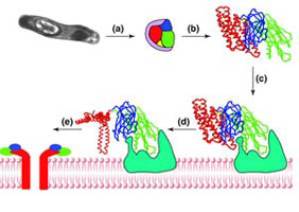
Рисунок 1.
Механизм действия Cry-токсинов.
(a)- кристалл попадает в
кишечник насекомого и растворяется; (b) - белок подвергается ферментативному
гидролизу, образуется "истинный токсин"; (с) - II и III домены
взаимодействуют с мембранным белком - рецептором; (d) - изменяется конформация
I-го домена; (e) - несколько молекул токсина образуют в мембране пору или
ионный канал.
Следующей стадией
токсического воздействия является связывание "истинного токсина" с
аффинным к нему белком (рецептором) на апикальной мембране эпителиальных клеток
кишечника. Связывание токсина с рецептором является обратимым [5, 6, 7]. Далее
происходит перестройка конформации молекулы токсина с последующим внедрением
его в мембранный бислой. После этого связывание токсина с мембраной становится
необратимым [5, 8]. Видимо, одновременно с внедрением в мембрану происходит ассоциация
нескольких молекул токсина [5, 9]. Ансамбль трансмембранных участков
ассоциированных молекул токсина образует пору или ионный канал. В первом случае
(образование поры), происходит гибель клеток по механизму
коллоидно-осмотического лизиса. Во втором (образование ионного канала) -
вследствие резкого изменения ионного состава и рН внутриклеточной среды [5].
Другой гипотетический
механизм образования поры в мембранах клеток - мишеней заключается в следующем.
После взаимодействия петель второго домена с рецептором он меняет свою
конформацию, затрагивая при этом пару спиралей первого домена, наиболее тесно
взаимодействующих со вторым. В результате чего петли и шпильки, соединяющие α-спирали
и расположенные ближе к мембране клетки-мишени входят в липидный бислой. Это, в
свою очередь, вызывает некоторые повреждения мембраны, в результате которых его
α-спирали пронзают мембрану и образуют пору [5].
Таким образом, из всего
вышеописанного можно сделать вывод, что на данный момент существует множество
подвидов Bt, отличающихся в той или
иной степени вирулентности и эффективности против различных видов насекомых.
Кроме того, на основе исследований зарубежных ученых следует, что большинство
штаммов Bt содержит комбинации разных Cry-токсинов. Эти комбинации,
как правило, проявляют синергический эффект. Синергизм может наблюдаться между
кристаллами и спорами Bt. Хотя действие кристалла – ключевой момент в
проявлении токсичности Bt, иногда необходимо присутствие и спор и
кристаллов [2].
Литература:
1. Кандыбин Н.В.
Бактериальные средства борьбы с грызунами и вредными насекомыми: теория и
практика. – М.: Агропромиздат, Москва: 1989. – 5 с.
2. Штерншис М.В.
и др. Биологическая защита растений. – М.: КолосС, Москва: 2004. – С. 118-143
3. Bacillus thuringiensis [Электронный ресурс] – Режим доступа:
https://ru.wikipedia.org. - Дата доступа: 25.11.2015
4.
Промышленная биотехнология // Биотехнология в сельском хозяйстве
// Энтомопатогенные препараты на основе бактерий [Электронный ресурс] - Режим
доступа: http://biotechnolog.ru. – Дата доступа: 25.11.2015
5. Статьи // Эндотоксины Bacillus thuringiensis [Электронный
ресурс] –
Режим доступа: http://rusbiotech.ru – Дата
доступа: 25.11.2015
6.
Hofmann C., P. Luthy,
Binding and activity of Bacillus thuringiensis delta-endotoxin to invertebrate
cells, 1986, Arch. Microbiology, 146: 7-11.
7.
Hofmann C., P. Luthy,
R. Hutter, V. Pliska, Binding of the delta-endotoxin from Bacillus
thuringiensis to brush-border membrane membrane vesicles of the cabbage
butterfly (Pieris brassicae), 1988, European Journal of Biochemistry, 173:
85-91.
8.
Ihara H., E. Kuroda,
A. Wadano, M. Himeno, Specific toxicity of d-endotoxins from Bacillus
thuringiensis to Bombyx mori, 1993, Bioscience, Biotechnology, Biochemistry,
57: 200-204.
9. Masson L, Tabashnik BE, Liu YB, Brousseau R, Schwartz
JL., Helix 4 of the Bacillus thuringiensis Cry1Aa toxin lines the lumen of the
ion channel, Journal of Biological Chemistry 1999 Nov 5;274(45):31996-2000.