Гоцуля А. С.
Запорізький державний медичний університет
ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ КАРБОНІЛЬНИХ
ПОХІДНИХ 7-((3-ТІО-4R-4H-1,2,4-ТРІАЗОЛ-5-ІЛ)МЕТИЛ)ТЕОФІЛІНУ
Похідні
1,2,4-тріазолу у наш час успішно використовуються у медицині як протимікробні
та протигрибкові засоби. Аналептична та діуретична дія теофіліну у поєднанні з
тріазольним фрагментом може дати неочікуваний результат, тому такі похідні
викликають зацікавленість наукової спільноти.
Мета роботи. Синтез,
фізико-хімічне та предиктивне дослідження карбонільних похідних 7-((3-тіо-4R-4H-1,2,4-тріазол-5-іл)метил)теофіліну.
Матеріали та методи
дослідження. Дослідження
фізико-хімічних властивостей отриманих нами сполук проводили за методами, які
наведені у Державній Фармакопеї України. Температуру плавлення визначали
відкритим капілярним способом на приладі Stanford Research Systems Melting Point Apparatus MPA100, Америка.
Будова речовин підтверджена за допомогою елементного аналізу на приладі
Elemental Vario EL cube (Elementar Analysensysteme, Німеччина), ІЧ-спектри
(4000 – 400 см-1) були зняті на модулі ALPHA-T спектрометра Bruker ALPHA FT-IR
(Bruker optics, Німеччина).
Прилад Liquid Chromatography System with Mass spectrometric detector
(Agilent Technologies, USA): Agilent 1260 Infinity HPLC System (дегазатор,
бінарний насос, автосамплер, термостат колонки, діодно-матричний детектор);
одноквадрупольний мас-спектрометр Agilent 6120 з іонізацією в електроспрей
(ESI); OpenLAB CDS Software. Умови проведення ВЕРХ-МС дослідження: 1) бінарний
градієнт - A: H2O (0,1 % розчин HCOOH), B: CH3CN (0,1 % розчин
HCOOH); 2) колонка: Zorbax SB-C18; 30 мм × 4,6 мм × 1,8 мм; 3)
температура колонки: 40 oC; 4) DAD: 210, 254 нм; 5) джерело іонів:
API-ES; 6) cканування в діапазоні m/z : 160-1000; 7) fragmentor: 10V; 8)
позитивна полярність; 9) температура нітрогену – 300 oC; 10) тиск на
небулайзері 40 psig; 11) швидкість газу-осушувача (нітрогену) - 10 л/хв.
Мас-спектри синтезованих сполук зняті на приладі Varian МАТ-311A (Varian,
Inc, USA) з безпосереднім введенням зразка в іонне джерело. Умови зйомки:
прискорююча напруга 3 кВ, струм емісії катода 300 мкА, тонізуюча напруга - 70
еВ.
Натрієва сіль
теофіліну, н-пропіловий естер теофілін-7-ацетатної кислоти, гідразид теофілін-7-ацетатної
кислоти та 2-(2-теофілін-7-іл) ацетил-N-R-гідразинкарботіоамід (R = CH3, C2H5, C6H5) були отримані за описаними раніше методиками [1].
1,3-диметил-7-((5-(2-оксопропілтіо)-4-R-4H-1,2,4-тріазол-3-іл)-метил)-1H-пурин-2,6(3H,7H)-діону. До 0,01 моль водного розчину натрій
гідроксиду додають наважку 0,01 моль 7-((3-тіо-4-R-4Н-1,2,4-тріазол-5-іл)метил)теофіліну
(R = CH3, C2H5, C6H5). До отриманого розчину додають у еквімолярній кількості бромацетон у
метанолі. Кип’ятять до нейтральної реакції середовища. Охолоджують і отриманий
осад відфільтровують, промивають водою. Перекристалізовано з суміші
метанол-вода (3:1). Біла кристалічна речовина, розчинна в спиртах та
ДМФА. 1Н ЯМР (CDCl3, 400 MHz), δ/ppm: 2,23 (с, 2Н, -СН2С(О)), 3,19 (c, 3H, -N3CH3), 3,35 (c, 3H, -N1CH3), 3,43 (т, 3H, -N4′CH3), 4,85 (c, 2H, -CH2), 6,98
– 8,06 (м, 8Н, Ar-H), 8,44 (c, 1H, =CH).
1,3-диметил-7-((4-R-5-(2-оксо-2-фенілетилтіо)-4H-1,2,4-тріазол-3-іл)метил)-1H-пурин-2,6(3H,7H)-діону.
До 0,01 моль
водного розчину натрій гідроксиду додають наважку 0,01 моль 7-((3-тіо-4-R-4Н-1,2,4-тріазол-5-іл)метил)теофіліну
(R = CH3, C2H5, C6H5). До отриманого розчину додають у еквімолярній кількості 2-бромо-1-фенілетанон
у метанолі. Кип’ятять до нейтральної реакції середовища. Охолоджують і отриманий
осад відфільтровують, промивають водою.
Перекристалізоване
з суміші метанол-вода (3:1). Жовта кристалічна речовина, розчинна в
спиртах та ДМФА. 1Н ЯМР (CDCl3, 400 MHz), δ/ppm: 2,23 (с, 2Н, -СН2С(О)),
3,19 (c, 3H, -N3CH3), 3,35 (c, 3H, -N1CH3), 3,43 (т, 3H, -N4′CH3), 4,85 (c, 2H, -CH2), 6,98
– 8,06 (м, 8Н, Ar-H), 8,44 (c, 1H, =CH).
7-((5-(2-(4-R1)-2-оксоетилтіо)-4-R-4H-1,2,4-тріазол-3-іл)метил)-1,3-диметил-1H-пурин-2,6(3H,7H)-діон.
До водного 0,01
моль водного розчину натрій гідроксиду додають наважку 0,01 моль 7-((3-тіо-4-R-4Н-1,2,4-тріазол-5-іл)метил)теофіліну
(R = CH3, C2H5, C6H5). До отриманого розчину додають у еквімолярній кількості 2-бромо-1-(4-R)етанон (де R1 = флуорофеніл, метоксифеніл) у метанолі.
Кип’ятять до
нейтральної реакції середовища. Охолоджують і отриманий осад відфільтровують,
промивають водою.
Перекристалізовано з суміші метанол-вода
(3:1). Білі або жовті кристалічні речовини, розчинні у спиртах та
ДМФА. 1Н ЯМР (CDCl3, 400 MHz), δ/ppm: 2,23 (с, 2Н, -СН2С(О)),
3,19 (c, 3H, -N3CH3), 3,35 (c, 3H, -N1CH3), 3,43 (т, 3H, -N4′CH3), 4,85 (c, 2H, -CH2), 6,98
– 8,06 (м, 8Н, Ar-H), 8,44 (c, 1H, =CH).
7-((4-R-5-(2-оксо-2-(тіофен-2-іл)етилтіо)-4H-1,2,4-тріазол-3-іл)-метил)-1,3-диметил-1H-пурін-2,6(3H,7H)-діон.
До 0,01 моль
водного розчину натрій гідроксиду додають наважку 0,01 моль 7-((3-тіо-4-R-4Н-1,2,4-тріазол-5-іл)метил)теофіліну (R = CH3, C2H5, C6H5). До отриманого розчину додають у
еквімолярній кількості 2-бромо-1-(тіофен-2-іл)етанон у метанолі. Кип’ятять до
нейтральної реакції середовища. Охолоджують і отриманий осад відфільтровують,
промивають водою.
Перекристалізоване
з суміші метанол-вода (3:1).
Біла
кристалічна речовина, розчинна в спиртах та ДМФА. 1Н ЯМР (CDCl3, 400 MHz), δ/ppm: 2,23 (с, 2Н, -СН2С(О)),
3,19 (c, 3H, -N3CH3), 3,35 (c, 3H, -N1CH3), 3,43 (т, 3H, -N4′CH3), 4,85 (c, 2H, -CH2), 6,98
– 8,06 (м, 8Н, Ar-H), 8,44 (c, 1H, =CH).
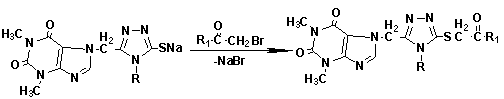
Рис. 1. Схема синтезу
карбонільних похідних 7-((3-тіо-4R-4H-1,2,4-тріазол-5-іл)метил)теофіліну
Результати та їх обговорення. На першому етапі роботи були визначені
оптимальні умови бромування відповідних кетонів (ацетону, ацетофенону,
4-метоксиацетофенону, 4-флуорацетофенону, 1-тіофен-2-іл-етанону) [7, 8]. Наступним етапом проведено реакцію
взаємодії вихідного тіолу з отриманим бромованим кетоном.
В 1Н ЯМР спектрах отриманих
сполук спостерігався ряд сигналів. В
сильній частині магнітного поля були зареєстровані сигнали –СН2-групи
у вигляді синглету в межах 4,85 - 4,65
м.ч. Сигнали протонів СН3-груп ксантинового синтону проявляються
інтенсивними синглетами в області 3,35 – 3,19 м.ч. (відповідно для N1CH3 та N3CH3). Сигнали протонів
метоксигрупи фіксуються у вигляді інтенсивного
синглету при 3,81 м.ч. СН3-радикал тріазолового синтону у четвертому
положенні підтверджен інтенсивним триплетом при 3,43 м.ч. Наявність С2Н5-радикалу
підтверджено за допомогою триплету протонів СН3-групи при 1,25 -
1,30 м.ч. та квадруплету протонів –СН2-фрагменту
при 4,08 м.ч. Ароматичні протони С6Н4-4-ОСН3 та
С6Н4-4-F фрагментів утворюють мультиплети в областях при 7,46 – 6,98 м.ч. та 8,06 –
7,27 м.ч. відповідно. Протон СН-групи імідазольного фрагменту характеризується
сигналом при 8,44 м.ч. Хімічний зсув протонів метиленової групи, пов’язаної з
кетоновим карбонілом, знаходиться в області 2,15 – 2,23 м.ч.
В ІЧ-спектрах S-етанонів
7-((3-тіо-4-R-4H-1,2,4-тріазол-5-іл)метил)-теофіліну
спостерігаються характерні смуги поглинання груп C=N і C=C при 1614 - 1580 і 1518 - 1474 см-1,
валентні коливання ароматичного СН–фрагменту
3095 – 3028 см-1 та C-F-фрагменту при 1143 см-1. Виражена полоса
валентних коливань кетонового карбонілу присутня в області 1682 – 1672 см-1
та ароматичної OCH3-групи
- 2825 см-1. S-CH2-фрагмент, безпосередньо
пов’язаний з карбонільною групою, створює деформаційні коливання при 1425 –
1410 см-1.
Висновки. Встановлені
оптимальні умови перебігу реакцій 7-((3-тіо-4R-4H-1,2,4-тріазол-5-іл)метил)теофіліну з електрофільними реагентами –
аліфатичнми, ароматичними та гетероциклічними α-бромкетонами. Проведено
хромато-мас-спектрометричне дослідження синтезованих сполук та підтверджено їх
структуру за допомогою 1Н ЯМР- та ІЧ-спектрометрії.
Література
1. Гоцуля А. С., Міколасюк О. О., Панасенко О.
І. та ін. Синтез і дослідження фізико-хімічних властивостей солей
2-(5-((теофілін-7’-іл)метил)-4-феніл-4Н-1,2,4-тріазлол-3-ілітіо)ацетатної
кислоти // Запорож. мед. журн. – 2014. – №1(82). – С. 91 - 94.
2. Pat.
2010/0168122 А1US, Int.Cl. C07D 473/04, А61К 31/522. Xanthine derivatives as selective HM74A agonists / R.
J. D. Hatley, A. M. Mason, I. L. Pinto. – Заявл. 08.08.2006; опубл. 01.07.2010.
3.
Pat. 7560450 B2 US, Int.Cl. C07D 473/06, А61К 31/522. Xanthine derivatives, the
preparation thereof and their use as pharmaceutical compositions / M. Eckhardt,
F. Himmelsbach, E. Langkopf, R. Maier. – Заявл. 18.11.2003; опубл. 14.07.2009.
4.
Pat. US 2012/0065236 А1, Int. Cl. A61K 31/426, А61Р 19/06, A61P 11/00. Methods for
concomitant of theophylline and febuxostat / L. Gunaward-hana, M. Tsai, H.
Naik. – Заявл. 08.09.2011; опубл. 15.05.2012.
5. Raafat M. Shaker. The chemistry of mercapto- and thionsubstituted 1,2,4-triazoles and their
utility in heterocyclic synthesis / Raafat M. Shaker // ARKIVOC. – 2006. – Vol. IX. – P. 59 – 112.
6.
The synthesis and the biological evaluation of new thiazolidine-4-one
derivatives containing a xanthine moety / F. G. Lupascu, O. M. Dragostin, L.
Foia, D. Lupascu et al. // Molecules, 2013. – № 18. – P. 9684 – 9703.
7. Левіч С. В. Синтез та фізико-хімічні властивості S-заміщених похідних 3-бензил-8-метил-7-[(4-феніл-5-тіо-4Н-1,2,4-тріазол-3-іл)метил]-ксантину / Левіч С. В., Шкода О. С., Александрова К. В. // Актуальні питання фармацевтичної і медичної науки та практики, 2013. – № 1 (11). – С. 54 – 58.
8. Пат. 61715, МПК (2011.01), С07D
473/00. Амід
4-феніл-5-(3'-метилксантиніл-7')метил-1,2,4-триазоліл-3-тіоацетатної кислоти,
який виявляє діуретичну, протизапальну та аналгетичну дії / Юрченко Д. М.,
Александрова К. В., Романенко М. І., Самура Б. А., Таран А. В. – Заявл.
17.01.2011; опубл. 25.07.2011.
9. Синтез, реакції та фізико-хімічні
властивості похідних 8-тіоксантиніл-7-ацетатних кислот / Д. М. Юрченко, К. В.
Александрова, М. І. Романенко, О. Б. Макоїд // Актуальні питання фармац. і мед.
науки та практики. – 2011. – Вип. XXIV, № 3. – С. 104 – 108.
10. Синтез та фізико-хімічні
властивості естерів ксантиніл-7-оцтової кислоти / К. В. Александрова, Д. М.
Юрченко, М. І. Романенко, О. О. Мартинюк // Актуальні питання фармац. і мед.
науки та практики. – 2010. – Вип. XXІІІ, № 1. – С. 7 – 10.