Жаңатілеу
Бауыржан Бақытұлы
М.Х.Дулати
атындағы Тараз Мемлекеттік Университеті
Гидротермальный метод
Некоторые диэлектрические материалы практически нерастворимы в
воде, солевых, щелочных и умеренно кислых растворах при обычном давлении и
сравнительно невысоких температурах, но заметно растворимы в так называемых
гидротермальных условиях в воде или водяном паре при температурах и давлениях
вблизи критических и выше. Гидротермальный метод выращивания монокристаллов за
последние десятилетия получил широкое распространение. Под термином
гидротермальная кристаллизация необходимо понимать комплекс физических и
химических процессов, проводимых в водных растворах солей, кислот и оснований
при повышенных температурах и давлениях ведущих к образованию соединений в
кристаллическом виде. К настоящему времени в гидротермальных условиях
синтезированы соединения практически всех минеральных классов. Основная
особенность гидротермальной кристаллизации — это использование аппаратуры
высокого давления с футеровкой, стойкой в условиях длительных технологических
циклов. Диапазон изменения режимов может колебаться от десятков и сотен
атмосфер при температуре до 250 °С, допускаемых при использовании тефлоновых
вкладышей до 600 - 700 С и многих тысяч атмосфер при синтезе корунда. Подобно
выращиванию из растворов при низких термодинамических параметрах
гидротермальная кристаллизация может происходить при постоянной температуре в
режиме прямого и обратного температурного перепада и при непрерывном
подпитывании. Ввиду сложности непосредственного наблюдения за кристаллизацией в
вышеуказанных условиях теоретическое обоснование гидротермальных процессов еще
далеко не окончено, поэтому вплоть до настоящего времени большинство работ, посвященных
гидротермальным исследованиям носят описательный характер. Между ростом
кристаллов из растворов, особенно из растворов в расплаве и ростом из
растворов гидротермальным синтезом, очень много общего. Гидротермальная
кристаллизация также протекает в три ступени - растворение исходных веществ с
предшествующей или одновременной химической реакцией образования, перенос
материала и образование зародышей новых фаз (часто заменяемое введением
затравок) и рост монокристаллов. Метод основан на использовании равновесной
концентрации кристаллизуемого вещества в растворе в зависимости от давления,
температуры и концентрации растворителя. Этот метод позволяет проводить
выращивание монокристаллов труднорастворимых и легколетучих соединений, в
частности, тугоплавких оксидных соединений, разлагающихся вблизи температуры
плавления при относительно низких температурах (за счет повышения давления), и
получать, кристаллы сложных составов, выращивание которых другими методами
невозможно. Кристаллы, получаемые из гидротермальных растворов обычно имеют
высокую степень структурного совершенства, малую плотность дислокации, в них
отсутствуют механические напряжения и пластические деформации. Оценивая
перспективность гидротермального метода на примере кварца можно утверждать, что
при наличии высококачественных затравок, прецизионной отработки технологии и
наличия надежно функционирующего оборудования в герметичной системе, работающей
при 750°С и 5 кбар, можно рассчитывать на получение сантиметровых кристаллов
любых оксидов. Вместе с тем нельзя не отметить, что гидротермальный метод обладает
недостатком: процессы, происходящие в автоклавах, особенно изменение
концентрации растворов и рост кристаллов, обычно не поддаются прямому
измерению и наблюдению. В зависимости от конкретных технологических параметров
кристаллизации гидротермальному синтезу присущи свои технологические
несовершенства, такие как, малая скорость роста, возможность загрязнения
выращиваемого материала компонентами растворителя и т.д. Ниже мы более подробно
рассмотрим основы гидротермального метода.
Гидротермальные реакции осуществляются в герметически закрытых
стальных реакторах (автоклавах), одна часть которых обычно нижняя (зона
растворения твердого вещества), содержится при более высокой температуре чем
верхняя (зона роста монокристаллов). В вышеуказанный контейнер в донную его
часть помещают исходный материал и заполняют его водным раствором кислоты, соли
или оснований до определенного объема. При нагревании за счет изменения
плотности к температуры раствора последний, заполняя емкость автоклава,
создает давление величина которого является функцией температуры и объема
раствора.
Из перегретого водного раствора солей, кислот и оснований растут
монокристаллы только в том случае, когда в системе твердое вещество - раствор
нарушено термодинамическое равновесие, т. е. имеется разность химических
потенциалов или свободных энергий между пересыщенным раствором и твердой фазой.
Для реализации процесса кристаллизации необходимо, чтобы в системе твердое тело
- раствор были созданы такие условия, при которых за счет образования зародыша
и последующего роста монокристалла произошло уменьшение свободной энергии (Т и
Р- const). В растворе такая ситуация осуществляется, когда он пересыщен. При
протекании кристаллизации число молей растворенных компонентов, как правило,
меняется, поэтому свободная энергия ( G ) представляет собой функцию не только
температуры и давления, но и числа молей, т.е. G=f(Т, Р, n1,n2,…ni)-
Изменение свободной энергии произвольной массы раствора при Р, Т- const
составит dG=∑μdni; где ni= масса компонентов
раствора выраженная числом молей.
Перед тем как приступить к кристаллизации из гидротермальных
растворов, необходимо с помощью диаграмм состояния растворитель-
кристаллизующееся вещество выбрать область рабочих давлений и температур. Для
понимания последнего вопроса сначала рассмотрим простейшую однокомпонентную
идеализированную систему в координатах температура - давление (рис.
11.1.3.1.). В этой системе при определенных температурах и давлениях
существует точка -ТAназываемая тройной точкой системы, в которой
твердая, жидкая и газообразная фазы находятся в равновесии. Далее перейдем к
рассмотрению трехмерной фазовой диаграммы (давление, температура, составы)
(рис. 11.1.3.2.). СА- критическая точка, а кривая ТАСА отвечает
одновременному существованию жидкой и газовой фазам. Монофаза, присутствующая
выше критической точки, не является ни истинной жидкостью ни истинным паром.
Она рассматривается как особое состояние материи и часто называется флюидной
фазой. Во флюидной фазе поверхностная энергия между газовой и жидкой фазами
стремится к нулю. Аналогичные критические точки появляются и в
двухкомпонентной системе. Геометрическое место этих точек образует непрерывную
кристаллическую кривую, соединяющую критическую точку одного компонента с
критической точкой другого точно так же как, тройные точки компонентов
соединяются кривой растворимости.
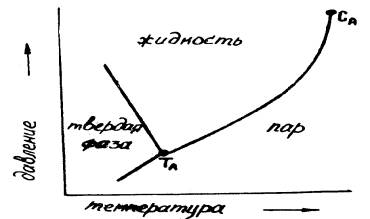 Рис.
11.1.3.1. Диаграмма температура – давление однокомпонентной системы
Рис.
11.1.3.1. Диаграмма температура – давление однокомпонентной системы