Химия и
химические технологии / 5. Фундаментальные проблемы создания новых материалов и
технологий.
Зайцева М. С.a, Ляпун В. О. a, к.х.н. Зайцева І. С. a, к.х.н. Комихов С. О. b,c
aХарківський
національний університет
міського господарства імені О. М. Бекетова, Україна
bНТК "Інститут
монокристалів" НАН
України, Україна
сХарківський
національний університет імені В. Н. Каразіна, Україна
Теоретичне вивчення комплексоутворення
імінодіоцтової кислоти з важкими металами
Значна
кількість найсучасніших методів очистки стічних вод від важких металів грунтуються на сорбції катіонів синтетичними або
напівсинтетичними полімерними матеріалами, які містять хімічно активні
функціональні групи, що здатні утворювати з катіонами важких металів міцні
комплексні сполуки. Розробка функціональних матеріалів з такими властивостями –
це та галузь матеріалознавства, яка швидко розвивається в наш час. Одержано
велику кількість хелатоутворюючих смол на основі штучних (полістирол і його
сополімери, поліакрилаті) й природних (хітозан) полімерів, що містять хелатуючі
групи різної природи [1]. Серед таких функціональних груп присутні, зокрема,
залишки імінодіоцтової кислоти (аналога ЭДТА) [2], гідроксихіноліну [3],
дитизону [4] та інших поширених комплексоутворювачів.
З великої
кількості різноманітних функціональних груп, які використано у розробці
полімерних комплексоутворювачів, фрагмент імінодіоцтової кислоти є одним з
найбільш простих. Матеріали на її основі – так звані Chelex 100 та Chelex 20
від Bio-Rad Laboratories, Inc. є поширеним засобом для очистки речовин за допомогою
іонного обміну. Експериментальні дані відносно селективності екстракції важких
металів за допомогою Chelex є загальнодоступними [5]. Імінодіоцтова кислота є
досить простою модельною сполукою для теоретичного вивчення рівноваги
комплексоутворення. Слід також відзначити високу конформаційну лабільність
функціональної групи на її основі, що, з одного боку, має ускладнювати розробку
селективного матеріалу для комплексоутворення, з іншого – можливо, дозволить
виявити наявність або відсутність впливу на комплексоутворення іонних радіусів.
Метою
даного дослідження є виявлення можливості теоретичної оцінки селективності
комплексоутворення імінодіоцтової кислоти з металами на основі квантовохімічних
розрахунків енергій відповідних комплексних сполук.
Для
вирішення цієї проблеми ми її розділили на дві складові, перша з яких –
кислотно-основна рівновага у імінодіоцтовій кислоті, друга – вже безпосередньо
комплексоутворення за її участю. Таким чином, для вирішення першого аспекту
проблеми ми розрахували енергії різних форм імінодіоцтової кислоти, у тому
числі нейтральну (IDAH2), протоновану, тобто катіонну (IDAH3+)
та її аніонні форми – з диссоціацією за першим ступенем та другим (відповідно
IDAH- та IDA2-). Розрахунки енергій проводились методом
RHF 6-31G(d,p) з урахуванням
MP2-кореляції та впливу розчинника (Н2О) методом PCM. На рисунку 1
наведено порівняльні величини рівней енергії для IDAH2, IDAH3++H3O+-H2O,
IDAH- + H2O - H3O+, IDA2-+
2H2O - 2H3O+.
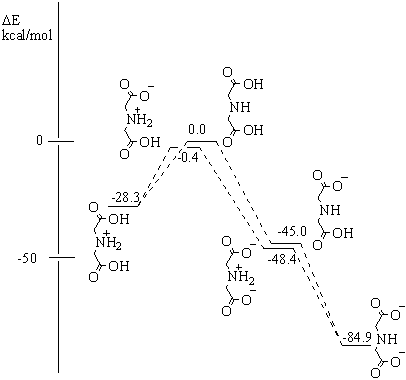
Рисунок 1 – Діаграма
енергій таутомерних форм імінодіоцтової кислоти, її катіону та аніонів (RHF 6-31G(d,p) + MP2)
Розрахунки
показують, що з двох електронейтральних форм імінодіоцтової кислоти дещо більш
стабільною є мезоіонна форма. Так само, для двох однозарядових аніонних форм
більш стабільною є форма з протонованим Нітрогеном. Таким чином, наведені дані
дозволяють відобразити схему кислотно-основної взаємодії у імінодіоцтовій
кислоті наступним чином:
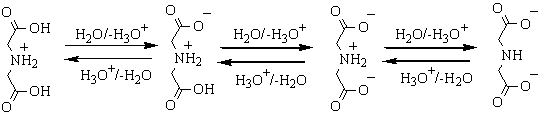
Очевидно,
що лише двозарядова аніонна форма (IDA2-) має здатність до утворення
стійких комплексів з металами, бо всі інші форми мають лише два потенційні
координаційнй центри, на відміну від трьох у IDA2-.
Розраховано
енергії комплексоутворення між діаніоном імінодіоцтової кислоти та рядом
металів двома способами.
Здійснено
оптимізацію геометрії комплексів аніону імінодіоцтової кислоти з катіонами
металів Li+, Na+, Mg2+, Ca2+, Fe2+,
Zn2+, Ni2+. Енергії відповідних
комплексів наведені в табл. 1.
Комплекс
катіону металу з тридентатним аніоном імінодіоцтової кислоти має будову близьку
до октаедричної.
Енергію
комплексоутворення розрахували за схемою (I спосіб):
E = E(комплексної
сполуки) – E(катіону металу) – E(IDA2-)
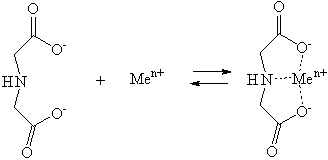
Mn+ = Li+, Na+, Mg2+,
Ca2+, Fe2+, Zn2+, Ni2+.
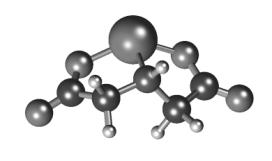
Рисунок 2 – Мінімізована
геометрія комплексу IDA2-Fe2+
З метою
пошуку більш простих розрахункових методів енергії комплексоутворення ми
вирішили перевірити, чи можливо в даному випадку використання адитивної схеми,
тобто енергію комплексоутворення пропонується розрахувати за схемою (ІІ спосіб):
E = 2E(зв'язку Mn+‑O) + E(зв'язку Mn+‑N).
Відповідні
величини E(зв'язку)
розраховано як різницю між енергіями: відповідно комплексних сполук Mn+‑OH- та Mn+‑NH3
і суми енергій катіону та ліганду (OH- або NH3):
E(зв'язку Mn+‑O) = E(Mn+‑OH-) – E(Mn+) – E(OH-);
E(зв'язку Mn+‑N) = E(Mn+‑NH3) – E(Mn+) – E(NH3)
Даний спосіб потребує мінімізації геометрії простих молекул [Mn+‑OH-] та [Mn+‑NH3] і значно менше комп'ютерного часу.
Знайдено,
що між обома способами є лінійна кореляція, що може свідчити, що комплексна
сполука не є конформаційно жорсткою, і відповідно, енергію комплексоутворення
можна добре розрахувати за допомогою адитивної схеми.
Встановлено,
що є кореляція між розрахованими енергіями комплексоутворення та адитивними
сумами відповідних зв'язків H(Mn+‑OH-) та H(Mn+‑NH3) (Рисунок 3).
Розрахунки показали тенденцію залежності між енергіями
комплексоутворення та описаними в літературі [5]
експериментально отриманими селективностями комплексоутворення (Рисунок 4).
Таблиця 1 –
Енергії комплексоутворення (RHF 6-31G(d,p)) та селективність екстракції [5]
|
Катіон Mn+ |
Енергія комплексної
сполуки еВ |
Енергія комплексо-утворення (І спосіб) ккал/моль |
Енергія комплексо-утворення (ІІ спосіб) ккал/моль |
Селективність екстракції (S) [5] |
log(S) |
|
Li+ |
-0,44 |
-278,04 |
-473,59 |
– |
– |
|
Na+ |
-0,38 |
-239,82 |
-392,18 |
0,0000001 |
-7 |
|
Ca2+ |
-0,80 |
-503,93 |
-745,80 |
0,013 |
-1,89 |
|
Mg2+ |
-0,98 |
-613,29 |
-920,35 |
0,009 |
-2,05 |
|
Fe2+ |
-1,01 |
-633,80 |
-939,88 |
0,13 |
-0,89 |
|
Zn2+ |
-1,03 |
-645,19 |
-982,70 |
1 |
0 |
|
Ni2+ |
-1,08 |
-678,90 |
-1035,87 |
4,4 |
0,64 |
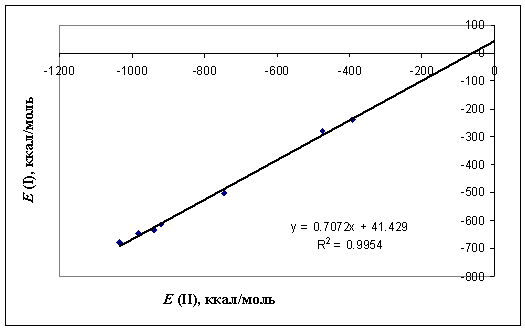
Рисунок 3 – Кореляція двох енергій комплескоутворення,
розрахованих двома
способами
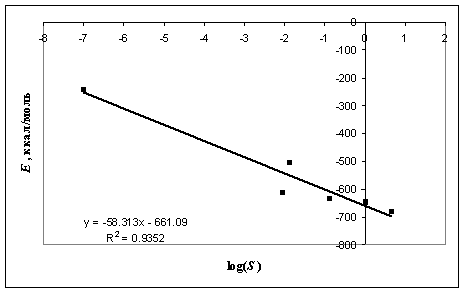
Рисунок 4 – Кореляція енергії комплексоутворення з
числами селективності
Таким
чином, селективність комплексоутворення у випадку аніону імінодіоцтової кислоти
може бути приблизно оцінена як адитивна сума відповідних складових енергій
зв'язків. Наявність подібної кореляції, швидше за все, свідчить про конформаційну
гнучкість фрагмента імінодіоцтової кислоти у комплексі, в наслідок чого
стеричний фактор, залежний від розміру катіону, у оцінці енергії
комплексоутворення є несуттєвим.
Література
[1] Oshita K., Motomizu Sh. // Bunseki Kagaku. – 2008. – V. 67. –No. 5.
– P. 291 ‑ 311.
[2] Chen C.-Y., Chen S.-Y. // J. Appl. Polym. Sci. –2004. –V. 94. –P.
2123 – 695.
[3] Gladis J. M., Rao T. P. // Anal. Bioanal. Chem. –2002. –V. 373. –P.
867 – 869.
[4] Wu D., Wang A., Guo L. // Anal. Sci. –2006. –Vol. 22. –P.
1245 – 1248.
[5] Chelex®100 and Chelex 20 Chelating Ion Exchange Resin Instruction Manual.
[6] Luo, H., S. Dai, Bonnesen, P. V. // Analytical Chemistry. – 2004. –
V. 76. –No. 10. – P. 2773 – 2779.
[7] Alex A. Granovsky, Firefly version 7.1.G, http://classic.chem.msu.su/gran/firefly/index.html.
[8] Flyes T. M., Gandour R. D., J. Inclusion Phenomena and Molecular
Recognition in Chemistry. – 1992. – V. 12. – Р. 313 – 332.