Самотьос Н.В.
Національний
університет харчових технологій
Пролін: характеристика, значення для організму,
можливості мікробного синтезу
Амінокислоти є основним «будівельним
матеріалом» для синтезу специфічних тканинних білків, ферментів, пептидних
гормонів та інших фізіологічно активних сполук. Крім того, що амінокислоти
утворюють білки, деякі з них також виконують роль нейромедіаторів або є їх
попередниками [1].
За своєю хімічною структурою амінокислоти
існують у двох формах (L та D форми). В процесі синтезу переважно утворюється
рацемат – суміш D- і L-форм амінокислот. D-форма не має фізіологічної цінності
для людини і тварини: вона не включається в обмін речовин і не засвоюється [2].
Амінокислота пролін належить до ряду замінних амінокислот та синтезується організмом людини за допомогою розщеплення про-колагенових
білків. Має таку структурну формулу (див. рис.).
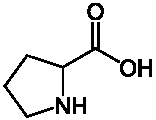
Рис. Структурна формула проліну
В
Україні 10-15% дорослого населення страждає захворюваннями суглобів і змушені
обмежувати свою активність, руху і спілкування з навколишнім світом [3]. Такі
захворювання, як артрити, артрози, остеопорози, остеохондрози пов'язані з
руйнуванням колагену – структурного білка всієї сполучної тканини. Саме пролін –
головний помічник у зміцненні суглобів, кісток, шкіри, волосся і нігтів. При
нестачі цієї амінокислоти в організмі людини спостерігається: ламкість нігтів,
випадіння волосся, болі в суглобах, кровоточивість ясен, крововиливи в шкірі.
Головна функція цієї амінокислоти в організмі – утримувати вологу в зовнішньому
шарі шкіри, що позитивно впливає на функціональний стан шкіри, сприяє її
зволоженню, регенерації. Має живильну і ранозагоючу дію. Чинить антиоксидантну
та зміцнюючу дію на шкіру в силу здатності нормалізувати мікроциркуляцію крові,
метаболічні процеси та оновлення клітин. Завдяки цьому, помітно поліпшує стан
шкіри, підвищує пружність і еластичність та користується попитом при
реабілітації після втручання пластичної хірургії [4].
Виробництво
проліну у тих масштабах, котрі потрібні суспільству, здійснюється двома
способами: мікробіологічним і хімічним синтезом. Обидва способи забезпечують отримання
природних амінокислот необхідної хімічної і оптичної чистоти, але при
хімічному синтезі отримують рацемати амінокислот, які потребують додаткового
розділення на оптичні ізомери [5]. Це є економічно невигідним, тому детальніше
розглянемо мікробіологічний синтез, що ґрунтується на вирощуванні певних видів
мікроорганізмів на поживних середовищах, що мають відповідне джерело вуглецю [6].
Після закінчення процесу ферментації амінокислоту виділяють з розчину хімічними
або фізичними методами. До переваг цього методу відносяться – невелика
кількість стадій отримання, а також відносно просте та універсальне обладнання.
З іншого боку є і свої недоліки: живі мікроорганізми, з якими доводиться
працювати, дуже чутливі до щонайменшої зміни умов навколишнього середовища, а
концентрація цільового продукту виходить низькою, що веде до збільшення
розмірів обладнання. Збільшити вихід амінокислот більше, ніж потрібно клітині
для росту і життєдіяльності вкрай важко, саме тому стали створювати ауксотрофні
та регуляторні мутанти [7].
Пролін
можуть синтезувати ауксотрофні та рекомбінантні штами деяких бактерій, таких як
Сorynebacterium glutamicum ATCC 21355
[8] ( ауксотрофний мутант, різкий приріст біомаси спостерігається при додаванні
у поживне середовище глутамату натрію); Corynebacteryum
glutamicum AJ11227 [9] (регуляторний мутант, який стійкий до аналогів
цільової амінокислоти, а саме до DL-3,4-дегідропроліну, що спричиняє бактеріостатичну
дію); Escherichia coli 702ilvA [10] (клітини
природнього штаму були оброблені мутагеном N-метил-N-нітро-N-нітрозогуанідином,
після чого було відібрано мутантний штам стійкий до аналогів проліну, а саме
3,4-дегідроксіпроліну та азетидин-2-карбоксилату – це доводить, що мутант
регуляторний, а також біосинтез проліну було збільшено за рахунок зміни
активності білка pYHGN), регуляторний штам Brevibacterium lactofermentum AJ 11225 [11] (клітини
природного штаму були обробленні N-метил-N-нітро-N-нітрозогуанідином). Узагальнену
характеристику технологічних особливостей одержання проліну з використанням різних
продуцентів наведено у таблиці.
Таблиця
Синтез проліну різними штамами мікроорганізмів
|
Біологічний агент |
Концентрація цільового продукту, г/л |
Особливості технологічного процесу |
|
Corynebacterium glutamicum ATCC 21355 |
38,9 |
Культивування
відбувається при рН середовища 7,2, з додатковим дворазовим підживленням при
постійній температурі. Температура культивування, 28 °С. Тривалість процесу
культивування 96 годин |
|
Corynebacterium glutamicum AJ 11227 |
12,0 |
Культивування
відбувається при рН середовища 7,0 з додатковим дворазовим підживленням при
сталій температурі 30°С Тривалість процесу культивування 72 години |
|
Еscherichia coli 702ilvA |
8,0 |
Культивування
відбувається при рН середовища 7,2 без додаткового підживлення. Температура
культивування, 37 °С. Тривалість процесу культивування 48 годин. |
|
Brevibacterium lactofermentum AJ 11225 |
22,5 |
Культивування
відбувається при рН середовища 7,0 з додатковим дворазовим підживленням. При
температурі 30 °С та тривалості процесу культивування 72 години. |
Враховуючи наведенні у
таблиці данні, можна зробити висновок, що найвищий
показник синтезу цільового продукту –
38,9 г/л, досягається при культивуванні культури С. glutamicum ATCC21355. Відповідно на другому місті за величиною
концентрації біомаси є штам B. lactofermentum AJ 11225 – 22,5 г/л. На третьому – концентрація кінцевого
продукту у культурі C. glutamicum AJ11227
–12 г/л, та найнижча концентрація кінцевого продукту у E. coli 702ilvA – 8 г/л. Однією із головних особливостей
культивування С. glutamicum ATCC21355 є
наявність у середовищі певної кількості біотину, а саме не менше ніж 5 мкг/л
поживного середовища. Саме ця невелика кількість вітаміну індукує структурно-функціональні зміни в клітинній
мембрані, завдяки чому збільшується її проникність та глутамінова кислота, перетворюючись
на пролін виходить з клітин у культуральне середовище [12].
Література:
1. Что
такое аминокислота? [Електронний ресурс] // Режим доступу: http://www.eurolab.ua/encyclopedia/565/44775/
2.
Васильківська М.К., Пенчук Ю.М. Сучасний стан та перспективи
біотехнологічних методів виробництва амінокислот // Наукові праці НУХТ. – 2007.
– Т. 45, № 7. – С. 12-15.
3. Журнал про бодибілдерів [Електронний ресурс] // Режим доступу: http://www.tvoytrening.ru/racion-sportsmena/40-aminokisloti.html
4. Цепколенко В.А. Показатели
антиоксидантной активности крови у женщин в различніх условиях реабилитации
после пластических хирургических вмешательств // ГП «Украинский НИИ медицині
транспорта» – 2005. – Т. 4, № 4 – С. 20-22.
5. Takors R., Bathe B., Rieping M., Hans S. Systems biology for
industrial strains and fermentation processes—Example: Amino acids // J.
Biotechnology. – 2007. – Vol. 129. – P. 181-190.
6. Блінов Н.П.
Основи біотехнології. – Київ: Наука, 1995. – 295 с.
7. Leuchtenberger W., Huthmacher K., Drauz K. Biotechnological
production of amino acids and derivatives: current status and prospects // Appl.
Microbiol. Biotechnol. – 2005. – Vol. 69. – P. 1-8.
8. Pat. 4444885 USA. Process for producing
L-proline by fermentation / T. Nakanishi, H. Hagino. – Publ. 24.04.84.
9. Pat. 4224409 USA Metod for producing
L-proline by fermentation / S. Nacamori, Y/ Hajumi – Publ. 23.09.80.
10. Пат. № 2215785 РФ. Способ получения
L-аминокислот, штамм escherichia coli
- продуцент L-аминокислоты / Е.А. Таболина // ЗАО
«НИИ» – 20.03.2011.
11. Pat. 4224409A US. Method for producing
L-proline by fermentation / S. Nakamori, H. Morioka. – Publ. 23.09.1980.
12. Пирог Т.П., Ігнатова О.А. Загальна біотехнологія: Підруч. – К.: НУХТ, 2009. – 335
с.