УДК 66.071.7
Исмаилов Б.Р., Кадирова Х.Б.
Южно-Казахстанский государственный
университет им. М. Ауезова,
СШ №85 им.
Х.Алимжана (г.Шымкент,
Казахстан)
Использование приближенно-аналитических выражений при тепловом расчете
химических реакций
Согласно закону Гесса, тепловой
эффект химической реакции, проводимой в изобарно-изотермических или
изохорно-изотермических условиях, зависит только от вида и состояния исходных
веществ и продуктов реакции и не зависит от пути её протекания. Значит, количество
теплоты, выделяющееся или поглощающееся при проведении химической реакции
является постоянной величиной, независимо от того, протекает ли данная реакция в
одну или в несколько стадий. Тепловой
эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с
выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с
ее поглощением (Q < 0; ΔH > 0) - к эндотермическим. Уравнение
реакции с указанием ее теплового эффекта называется термохимическим. Например:
CH4 + 2O2 = CO2 + 2H2O + Q.
Если теплоту реакции отнести к 1 моль определенного
вещества, то в термохимическом уравнении некоторые стехиометрические
коэффициенты могут быть дробными. Например:
C6H6(;) + 7?5O2 6CO2(u) + 3H2O + 3301?6 rL;|vjkm
Обозначим исходные вещества
через А1, А2… , а продукты реакций -
В1, В2…. Реакция может быть осуществлена различными путями в одну, две или три
стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Тогда по
закону Гесса, тепловые эффекты всех этих реакций связаны следующим
соотношением:
ΔH1
= ΔH2 + ΔH3 = ΔH4 + ΔH5 + ΔH6. (1)
Для практики часто используются
три следствия из закона Гесса:
1. Тепловой эффект прямой
реакции равен по величине и противоположен по знаку тепловому эффекту обратной
реакции.
2. Тепловой эффект химической
реакции равен разности сумм теплот образования продуктов реакции и исходных
веществ, умноженных на стехиометрические коэффициенты.
3. Тепловой эффект химической
реакции равен разности сумм теплот сгорания исходных веществ и продуктов
реакции, умноженных на стехиометрические коэффициенты.
Таким образом, пользуясь
табличными значениями теплот образования или сгорания веществ, можно рассчитать
теплоту реакции, не прибегая к эксперименту. Табличные величины теплот
образования и сгорания веществ обычно относятся к т.н. стандартным условиям.
Для расчёта теплоты процесса, протекающего при иных условиях, необходимо
использовать и другие законы термохимии, например, закон Кирхгофа, описывающий
зависимость теплового эффекта реакции от температуры.
В некоторых случаях, особенно
когда необходимо проводить серийные расчеты теплот образования различных
реакций и связанные с ними другие расчеты термохимии может быть полезным
использование приближенно-аналитических выражений.
Расчет
теплового эффекта по грубому уравнению Кирхгофа
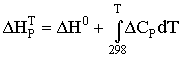 , (2)
, (2)
где ![]() – тепловой эффект химической реакции при температуре Т;
– тепловой эффект химической реакции при температуре Т;
![]() – разность
теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических
коэффициентов,
– разность
теплоемкостей продуктов реакции и исходных веществ с учетом стехиометрических
коэффициентов,
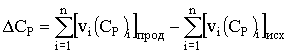 , (3)
, (3)
где ![]() – теплоемкости
соответствующих веществ.
– теплоемкости
соответствующих веществ.
Для ориентировочных расчетов
разность теплоемкостей продуктов реакции и исходных веществ вычисляются с
использованием табличных данных.
Однако, при проведении серийных расчетов целесообразно использовать для ![]() приближенно-аналитические
выражения и выполнить интегрирование с применением одной из квадратурных формул
[3]:
приближенно-аналитические
выражения и выполнить интегрирование с применением одной из квадратурных формул
[3]:
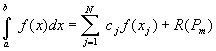 ,
(4)
,
(4)
где ![]() ) – подынтегральная функция;
) – подынтегральная функция; ![]() ,
, ![]() - коэффициенты и узлы
квадратурной формулы, соответственно;
- коэффициенты и узлы
квадратурной формулы, соответственно;![]() - остаточный член при
аппроксимации подынтегральной функции многочленом степени m.
- остаточный член при
аппроксимации подынтегральной функции многочленом степени m.
Применим
данный подход для термодинамического расчета химической
реакции ![]() (5)
(5)
в интервале температур от 298
до 1000 К и давлениях 0,1; 2; 10 МПа с исходными термодинамическими данными [1,2].
Результаты расчета разности теплоемкостей продуктов реакции и исходных веществ
сведем в таблицу.
Таблица значений разности теплоемкостей продуктов реакции и
исходных веществ в зависимости от
температуры.
|
T, К |
Дж/моль |
|
300 |
-9,30 |
|
400 |
-8,64 |
|
500 |
-6,65 |
|
600 |
2,56 |
|
700 |
3,39 |
|
800 |
6,58 |
|
900 |
9,23 |
|
1000 |
11,53 |
Аппроксимацию расчетных данных
представим в виде многочленов первой или второй степени ![]() =
=![]() ,
,
![]() =P
=P![]() (T)=
(T)=![]() ,
,
где ![]() - коэффициенты
эмпирических многочленов первой или второй степени, аппроксимирующих табличные
данные с наименьшим отклонением.
- коэффициенты
эмпирических многочленов первой или второй степени, аппроксимирующих табличные
данные с наименьшим отклонением.
Физико-химические параметры
для расчета теплоты реакции взяты из таблицы [1,2]:
|
Вещество |
кДж/моль |
Дж/моль |
кДж/моль·К |
Коэффициенты уравнения |
Ткр, К |
Pкр, МПа |
|||
|
|
|
|
|
||||||
|
|
-167,19 |
386,8 |
146,7 |
3,080 |
565,8 |
-300,4 |
- |
507,9 |
3,03 |
|
|
20,41 |
226,9 |
63,89 |
3,305 |
235,86 |
-117,6 |
- |
365 |
4,62 |
|
|
-103,9 |
269,9 |
73,51 |
-4,80 |
307,3 |
-160,16 |
- |
370 |
4,26 |
Составляя
систему уравнений для ![]() и решая ее, получим,
например для многочлена первой степени:
и решая ее, получим,
например для многочлена первой степени:
![]() =
=![]() . (6)
. (6)
Подставляя
(6) в (2) получим
![]() =
=![]() +
+![]() . (7)
. (7)
Формула (7)
может быть использована при расчетах изменения изобарно-изотермического
потенциала по приближенному уравнению
![]() , (8)
, (8)
где М0 – коэффициент, зависящий от
температуры
Литература
1. Краткий справочник физико-химических
величин. Под редакцией А.А. Равделя и А.М. Пономарёвой. – Л.: Химия, 1983.
-232с.
2.Белоклокова.Т.М, Жирнов
Б.С, Алексеев.С.В, Евдокимова.Н.Г. Термодинамический расчет химических реакций.
– Уфа.: УГНТУ,1997.-19с.
3. Бахвалов Н., Жидков Н.,
Кобельков Г. Численные методы. М СПб.:
Физматлит. -2002.- 630с.