Биологические
науки / 6.Микробиология
Скляр Т.В.,
Крисенко О.В., Вінніков А.І., Овсинська Т.О.
Дніпропетровський національний університет
ім. Олеся Гончара
УМОВНО-ПАТОГЕННА МІКРОФЛОРА ШЛУНКОВО-КИШКОВОГО ТРАКТУ
ЛЮДИНИ
В останні
десятиріччя відмічають зростання кількості дисбіотичних розладів кишечника.
Зміни екологічного стану довкілля, нераціональне харчування, перенесені гострі
кишкові інфекції, хронічні захворювання та дисфункція шлунково-кишкового
тракту, широке застосування антибіотиків, зниження імунологічної реактивності
організму можуть бути причинами порушень рівноваги між представниками
резидентної мікрофлори і виникнення дисбактеріозу кишечника. Особливого
значення набуває необхідність стеження за мікробіоценозом кишечника
новонароджених та дітей перших років життя, оскільки первинно сформований
мікробний пейзаж визначає стан мікроекологічного статусу дитини протягом всього
життя [7].
Метою роботи
було провести аналіз частоти виявлення умовно-патогенних мікроорганізмів,
виділених з шлунково-кишкового тракту, та їх стійкості до антибіотиків.
Відповідно до
мети роботи було поставлено наступні задачі:
1)
визначити склад мікрофлори шлунково-кишкового тракту здорових людей та осіб
з підозрою на дисбіоз;
2)
виділити, ідентифікувати та вивчити чутливість до антибіотиків виділених
штамів.
З величезного
числа мікроорганізмів, що безупинно попадають у травний тракт людини, тільки
визначені види мікробів знайшли в ньому сприятливі умови для існування.
Розрізняють
дві основні групи мікроорганізмів:
– облігатні,
тобто мікрофлора, характерна для даного виду;
–
транзиторні, випадкова для даної локалізації мікрофлора.
Також існує
поняття «індигенна мікрофлора», яке включає всі штами мікроорганізмів, виділені
від кожної окремої особини. До складу індигенної флори можуть входити як
сапрофітні мікроорганізми, так і умовно-патогенні, що виділені з даного
організму.
У мікрофлорі
шлунково-кишкового тракту (ШКТ) розрізняють порожнинну флору, що локалізується
в просвіті кишечнику, і пристінкову, або мукозну (М-), що тісно зв'язана зі
слизуватою оболонкою й утворює «бактеріальний дерен». Ця зона складається з
трьох шарів:
– товстий
поверхневий шар слизу, що закриває просвіт крипт;
– глікокалікс
покриває суцільним шаром колоноцити;
– ділянка
пристінної зони – простір, обмежений мембранами бічних поверхонь мікроворсинок
і з рядом мікроекологічних особливостей, що відрізняються від умов у просвіті
кишки [4, 6].
У цих трьох
шарах живуть мікроорганізми, що відносяться до М-флори. Вони підвищують
колонізаційну резистентність кишки.
Формування
якісного і кількісного складу мікрофлори регулюється складними антагоністичними
і синергічними відносинами між окремими представниками в складі її біоценозів,
а також контролюється фізіологічними факторами макроорганізму. До основних
механізмів, що лімітують бактеріальний ріст, відносять коливання рівня
кислотності в шлунку і нижчих відділах, стан кишкової моторики, регенераторну
здатність епітелію й інші фактори [6].
Усі бактерії
попадають у ШКТ оральним шляхом. Щільність бактерій у шлунку, стравоході і
кишківнику відповідно дорівнює 1 000, 10 000 і
1 000 000 000 у 1 мл вмісту кишечника. У шлунку і тонкому
відділі кишечнику мікрофлора надзвичайно убога, у товстому ж його відділі
утримується величезна кількість мікроорганізмів. У товстій кишці людини мається
приблизно 1,5 кг мікроорганізмів, а в 1 см3 фекалій – до 250 млрд.
Людина виділяє з випорожненнями в добу понад 17 трильйонів мікробів, і по вазі
вони складають 1/3 сухих випорожнень.
Незважаючи на
безперервний інтенсивний потік і розробку нових антибактеріальних препаратів,
проблема боротьби з інфекційно-запальними захворюваннями залишається однією з
найбільш складних і актуальних проблем для лікарів у всьому світі. Особливої
уваги набуває питання стійкості до антибіотиків мікроорганізмів, що колонізують
ШКТ, так як пероральний спосіб застосування антибіотиків є найбільш
розповсюдженим. Загроза в цьому сенсі перш за все виникає для сапрофітних
бактерій, що першими вражаються при застосуванні антибіотичних препаратів.
Натомість умовно-патогенні мікроорганізми, які здебільшого є представниками
транзиторної флори, переважно виживають при застосуванні антибіотиків і більш
того отримують додаткові сприятливі умови для здійснення колонізації ШКТ.
Умовно-патогенні види бактерій переважно
набувають детермінант резистентності до антибіотиків за допомогою процесів
генетичної рекомбінації [3, 9]. При потраплянні до наступного хазяїна, ці
бактерії перетворюються на резервуар генів резистентності [2]. У деяких
випадках резистентні мікроби, що не є облігатними патогенами приймають на себе
функції таких, і сьогодні в клініці вже існує декілька видів полірезистентних
мікроорганізмів: E. faecium, P. aeruginosa, S. aureus [1, 12], з яких
ентерокок є представником облігатної флори кишечника, а стафілокок доволі часто
виступає як патоген або маркер дисбіозу. Отже, препарат стає ефективним в першу
чергу проти мікроорганізмів, які не мають факторів резистентності, а це
призводить до зникнення сапрофітних бактерій [12]. Серед таких бактерій
більшість є представниками нормальної мікрофлори, і насамперед це лактобацили
та біфідобактерії, кількість яких може знижуватися у 105-106
разів. Застосування антибіотиків призводить до знищення патогенів, але водночас
і значно пригнічує сапрофітні мікроорганізми, що також при відсутності корекції
можуть стати чинником дисбактеріозу [5].
Об'єктом дослідження був біологічний матеріал (кал),
отриманий від осіб з підозрою на дисбіоз. Культури, що виділені на
селективних середовищах та середовищах збагачення ідентифікували згідно
«Приказа МОЗ СССР № 535 от 22.04.1985 г.»
[10].
Весь отриманий матеріал (38 зразків) було проаналізовано на
склад мікрофлори з метою визначення відповідності його складу нормі чи
дисбіозу. В разі виявлення умовно-патогенних мікроорганізмів їх відсівали,
ідентифікували до виду та вивчали їх біологічні властивості. Предметом подальших
досліджень були штами умовно-патогенних мікроорганізмів родів Staphylococcus (10
штамів), Klebsiella
(4 штами), Proteus (4 штами), Pseudomonas (2 штами), лактозонегативні
E.
coli (2 штами), виділені із
біологічного матеріалу від осіб із дисбіотичними порушеннями ШКТ.
Антибіотикорезистентність
виділених штамів визначали диск-дифузійним методом. Тестували чисті культури
умовно-патогенних мікроорганізмів, виділені з матеріалу від осіб з дисбіозами.
З добової
культури отримували суспензію клітин, яка містила 1×106
клітин/мл. На стерильну чашку з МПА вносили 0,1мл такої суспензії і розтирали
краплю шпателем по поверхні. Пінцетом брали стерильні диски з антибіотиками і
розкладали їх по поверхні поживного середовища, засіяного культурою
мікроорганізмів. На чашку уміщували не більше 6 штук дисків з антибіотиками. Використовували
диски з азітроміцином, гентаміцином, роксітроміцином, цефтриаксоном, цефепімом,
амікацином, офлоксацином, ципрофлоксацином, левофлоксацином, гатіфлоксацином,
кліндаміцином, меропенемом, доксіцикліном.
Облік
результатів проводили через 18 годин після розкладання дисків [11]. Проводили
вимірювання зони відсутності росту навколо диску. Чутливість або резистентність
ізоляту встановлювали відповідно до таблиці зон затримання росту для
стандартних дисків з антибіотиками.
В ході досліджень складу мікрофлори ШКТ осіб із підозрою на дисбіоз було
визначено, що у 26 (68,4%) осіб з 38 обстежених є дисбіоз. Наявність дисбіозу
було встановлено за зниженням кількості біфідобактерій і появою у кількостях
більше ніж 103 клітин/г умовно-патогенних мікроорганізмів.
З отриманих даних очевидним є те, що у всіх осіб із дисбіозами присутні
представники тих чи інших родів умовно-патогенних мікроорганізмів. У деяких осіб
(42,3%) кількість цих бактерій не перевищує граничного значення норми і дисбіоз
встановлено лише за ознакою зниження кількості біфідобактерій та лактобацил,
водночас є і пацієнти (11,5%) у яких кількість біфідобактерій та лактобацил
становить значення відповідні стану норми, а кількість деяких представників
умовно-патогенних бактерій значно перевищує показник встановлений для норми. У
більшості ж обстежених осіб (46,2%) у матеріалі визначено одночасно зниження
порівняно із нормою кількості біфідобактерій і лактобацил при виявленні більших
за норму концентрацій представників умовно-патогенної флори.
Нами було проаналізовано частоту виявлення всіх виділених у концентраціях
вищих за норму мікроорганізмів (рис. 1). В ході дослідження було встановлено,
що у 10 осіб більшим за норму був показник
кількості представників роду Staphylococcus, у 6 – Candida,
у 4 – Klebsiella та Proteus
і 2 –Pseudomonas та лактозонегативних E.coli.
У деяких випадках (23,1%) було
зафіксовано одночасне підвищення за межі норми двох представників
умовно-патогенної флори.
В дослідженнях найбільш часто виявляли стафілококи, які потім
ідентифікували до виду. Було визначено, що 80% штамів були представлені
золотистим стафілококом, а 20% – сапрофітним. Таке широке виявлення
стафілококів вірогідно може бути пов’язане із значним поширенням його носійства
серед пацієнтів.
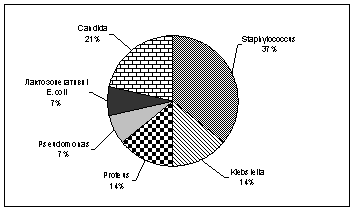
Рис. 1
Частота виявлення умовно-патогенних мікроорганізмів у пацієнтів з дисбіозами
Друге місце за частотою виявлення займали дріжджоподібні грибки роду Candida, які особливого значення набувають у пацієнтів з
порушеннями імунітету. Найменш часто виділяли псевдомонади. Власне для них ШКТ
не є типовим біотопом, тому їх представництво мінімальне, водночас вони в обох
випадках виявлені в пацієнтів з нормальним вмістом біфідобактерій та
лактобацил, тобто вони не є значними антагоністами нормофлори і володіють
низькими конкурентними властивостями.
Сумарне виділення мікроорганізмів – представників родини ентеробактерій
складає 35%, тобто майже третина від всіх виділених штамів. Представники родини
ентеробактерій сьогодні поряд зі стафілококом вважаються одними з найбільш
розповсюджених чинників випадків внутрішньолікарняних захворювань.
Вивчення чутливості до
антибіотиків виділених штамів
В
дослідженнях вивчали антибіотикорезистентність 10 штамів Staphylococcus, по 4 штами Klebsiella та Proteus і по 2 штами
Pseudomonas та лактозонегативних E. coli. Було встановлено (рис. 2), що більшість виділених штамів
умовно-патогенних мікроорганізмів володіли стійкістю хоча б до одного
препарату.
З
представлених на рисунку 2 даних очевидно, що найбільший рівень стійкості всі
виділені штами проявили до доксіцикліну (100%), офлоксацину (більше 70%).
Високий рівень стійкості стафілококи виявили до офлоксацину (75%) та цефепіму
(62,5%). Найбільш стійкими виявилися штами лактозонегативної E. coli, обидва проявили
чутливість до гатіфлоксацину, та один ще до кліндаміцину та цефтриаксону.
Вірогідно, такий високий рівень стійкості можна пояснити частим застосуванням
антибіотиків різних класів, що застосовувалися для лікування і діяли як фактор
відбору.
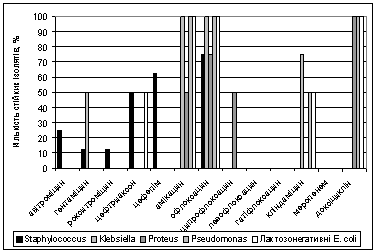
Рис. 2 Розповсюдження
стійкості до антибіотиків серед виділених штамів умовно-патогенних
мікроорганізмів
Набуття резистентності умовно-патогенними
мікроорганізмами є небезпечним з-за того, що за допомогою процесів генетичної
рекомбінації резистентність передається іншим мікроорганізмам, і якщо раніше
мова йшла лише про внутрішньовидову передачу, то тепер отримані дані і про
міжвидове перенесення подібної інформації [1, 9]. У навколишньому середовищі
такі мікроорганізми стають резервуаром генів резистентності. У деяких випадках
резистентні мікроби, що є умовно-патогенними, починають виступати як
повноправні патогенні мікроорганізми. Сьогодні вже є дані про виявлення
полірезистентних збудників серед S.
aureus та P. aeruginosa [1].
1. Визначено, що з 38 досліджених зразків біологічного матеріалу у 26
(68,4%) склад мікроорганізмів відповідає ознакам дисбіозу. У 42,3% визначено
лише зниження кількості біфідобактерій та лактобацил, у 11,5% визначено лише
перевищення показнику норми представників умовно-патогенних бактерій, у 46,2%
визначено одночасно зниження порівняно із нормою кількості біфідобактерій і
лактобацил при виявленні більших за норму концентрацій представників
умовно-патогенної флори.
2. Встановлено, що розподіл за частотою виявлення при дисбіозі
умовно-патогенних мікроорганізмів наступний:
37% – Staphylococcus,
21% – Candida, 14% – Klebsiella та Proteus і по 7% – Pseudomonas
та лактозонегативні E.coli. У 23,1% було визначено одночасне підвищення за межі норми двох
представників умовно-патогенної флори.
3. Найбільше стійких штамів було виявлено до доксіцикліну (100%), офлоксацину
(більше 70%) та цефепіму (62,5%). Найбільш стійкими виявилися штами
лактозонегативної E. coli, обидва проявили
чутливість до гатіфлоксацину, та один ще до кліндаміцину та цефтриаксону.
Література:
1.
Барбоса Т.М. Использование
антибиотиков и резистентность: что скрывается в тени? / Т.М. Барбоса, С.Б. Леви //
Клиническая антибиотикотерапия. – 2001. – №3. – С. 30-32.
2.
Бондаренко В.М. Общий анализ представлений
о патогенных
и условно-патогенных бактериях / В.М. Бондаренко // Журнал микробиологии, эпидемиологии и
иммунологии. – 2000. – № 4. – С. 20-26.
3.
Бухарин О.В. Механизмы выживания
энтерококков в организме хозяина / О.В. Бухарин, С.И.
Билимова,
К.Л. Чертков // Журнал микробиологии. – 2002. – №3. – С.100-106.
4.
Бухарин О.В.
Экологическая детерминированность внутривидового разнообразия патогенных
бактерий / О.В. Бухарин, В.А. Гриценко // Журнал микробиол. – 2000. – №1. – С.
103-106.
5.
Дисбактериозы желудочно-кишечного тракта (диагностика, профилактика и
лечение): методические рекомендации. – М: МЗ РФ, 1997. – 40 с.
6.
Кличическая гастроэнтерология /под ред про. Г.И. Бучинского. – К.:
Здоров’я, 1988. – С. 159-247.
7.
Козлова Э.П. Динамика становления микрофлоры здоровых доношенных
новорожденных детей / Э.П. Козлова, Г.И. Гончарова, М.П. Семенова //
Журнал микробиология. – 1997. – № 2. – С. 73-79.
8.
Козько В.М. Принципи терапії гострих кишкових інфекцій з урахуванням
мікробіоценозу кишечнику / В.М. Козько, А.В. Бондаренко, К.В. Юрко //
Сучасна гастроентерологія. – 2002. – №4. – С. 25-31.
9.
Навашин С.М. Фармакокинетические показатели антибиотиков и их значение при
разработке схем антибактериальной терапии, прогнозе эффективности / С.М.
Навашин, П.С. Навашин // Антибиотики и химиотерапия. – 1993. – №10-11. – С.
26-34.
10. Об унификации
микробиологических (бактериологических) методов исследования, применяемых в
клинико-диагностических лабораториях лечебно-профилактических учреждений:
приказ № 535. – [чинний від 22.04.1985р.]. – М.: МОЗ СССР, 1985. – 65с.
11. Теория и практика
определения чувствительности микроорганизмов к противомикробным препаратам
диск-диффузионным методом / М.С. Поляк, М.Г. Авдеева, Д.Л. Мойсова [и др.] //Клиническая
лабораторная диагностика. – 2003. – № 1. – С.25-32.
12. Фадєєнко Г.Д.
Антибактеріальна терапія: більше користі чи шкоди? / Г.Д. Фадєєнко //
Сучасна гастроентерологія. – 2002. – №4. – С. 22-24.