Химия и химические
технологии/5.Фундаментальные проблемы создания новых материалов и
технологий
Д.х.н. Алыков Н.М., аспирант Кутловская Е.В.
Астраханский
государственный университет, Россия
СОРБЦИЯ АНТИГИСТАМИННЫХ
ПРЕПАРАТОВ НА УГЛЕРОДНЫХ НАНОТРУБКАХ
В медицинской практике широко используются
антигистаминные препараты, предотвращающие вызванные гистамином сокращение
гладкой мускулатуры кишечника и бронхов, повышение проницаемости стенок сосудов
и развитие отёков; они обладают умеренной холинолитической и
местноанестезирующей активностью и оказывают угнетающие влияние на центральную
нервную систему. Несмотря на различие в общем строении большинства
антигистаминных препаратов (АГП), у них есть и общие структурные элементы
молекул, которые нельзя не отметить (формулы 1-7).
|
|
|
|
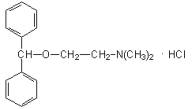
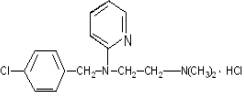
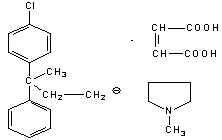
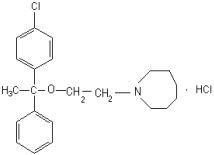
1. Димедрол |
2. Дипразин |
|
|
|
|
|
|
|
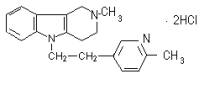
3. Димебон |
4. Диазолин |
|
|
|
|
|
|
|
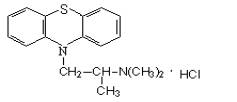
5. Супрастин |
6. Тавегил |
|
|
|
|
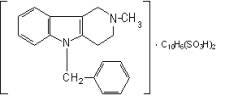
7.Сетасин |
|
Целью работы явилось изучение сорбционного
концентрирования ряда АГП на углеродных нанотрубках. Эти исследования
необходимы при поиске материалов и способов удаления АГП из биологических
объектов и, прежде всего, из крови. Подобные исследования необходимы в
гемосорбции. Те материалы, которые используются в гемосорбции, не должны
уноситься с очищаемым материалом, т.е. они должны быть высокопрочными, не
разрушаться при физических нагрузках, быть нетоксичными и иметь большую
сорбционную емкость. Именно углеродные сорбенты отвечают этим требованиям.
Экспериментальная часть
Материалы и методика. Углеродные нанотрубки (УНТ) – цилиндрические
структуры с диаметром от одного до нескольких десятков нанометров и длиной
несколько микрон, состоящие из одного или нескольких свернутых в трубку
графитовых слоев с гексогональной организацией углеродных атомов. Трубки
закачиваются полусферической головкой, образованной из половинки фуллерена. В
работе использованы углеродные нанотрубки «Таунит» производства ООО
«НаноТехЦентр» (г.Тамбов) с наружным диаметром 20-70 нм, внутренним диаметром
5-10 нм, длиной 2000 и более нм, насыпной плотностью 0,4- 0,6 г/см3,
удельной поверхностью более 120 м2/г.
Буферые растворы аммонийно- ацетатные с рН от
3 до 11.
Для изучения изотерм сорбции была использована
индикаторная реакция окисления в щелочной среде различных АГП перманганатом
калия. В результате протекания окислительно-восстановительной реакции раствор
окрашивается в зелёный цвет, интенсивность окраски зависит от концентрации АГП
в этом растворе.
Адсорбция
в статическом режиме. В 10 градуированных пробирках ёмкостью 10 см3
вносят 0;0,05; 0,10; 0,20; 0,50; 0,80; 1,0; 2,0; 4,0 и 6,0 см3
0,001М водного раствора индивидуального АГП. Вносят буферный раствор с рН 6 до
10 см3 и отбирают по 5 см3 полученных растворов в другие
пробирки ёмкостью 10 см3. Отдельно по времени в каждую пробирку
вносят 1 см3 2н. водного раствора гидроксида калия и по 4 см3
0,01н. раствора перманганата калия. Через 5 мин (фиксация времени по
секундомеру) быстро измеряют оптическую плотность раствора при 670 нм в кювете
толщиной 2 см относительно нулевого раствора. По полученным величинам оптических
плотностей растворов строят градуировочный график в координатах «оптическая
плотность – концентрация АГП». В такие же градуированные пробирки вносят по 0,
0,05, 0,1 … 6 см3 0,001М раствора АГП буферный раствор с рН 6 до 10
см3 и по 0,5 г сорбента. Встряхивают 10 мин, далее центрифугируют 10
мин при 3000 об/мин и отбирают в другие пробирки по 5 см3
осветлённых фракций. В отобранные пробы так же последовательно по времени
вносят по 1 см3 2н раствора КОН, 4 см3 0,01н. КмnО4,
перемешивают и через 5 мин измеряют оптическую плотность раствора при 670 нм в
кювете толщиной 2 см относительно нулевого раствора. Последовательно
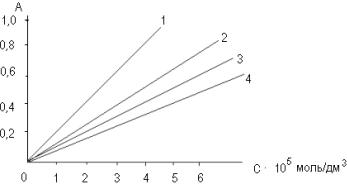
проделывают эту работу с каждым раствором. Результаты опытов приведены на рис.
1 (для примера приведен один из представителей АГП – супрастин).
|
|
|
Рис.1. Оптические плотности
раствора КМпО4 в среде 2н. КОН через 1 минуту после внесения
супрастина с концентрацией (0 – 6)∙10-5 моль∕дм3
(Т=298К, прямая 1, градуировочный график), то же после сорбции супрастина на
УНТ. Время сорбции 20 мин, температура 278±1К (2), 298±1К (3), 313±1К (4).
Ионная сила 0,05 (КСl), толщина кюветы – 2
см, измерения относительно нулевого раствора, длина волны 670 нм. |
Равновесные концентрации АГП находят по
градуировочному графику. Найденные значения равновесных концентраций и величины
исходных концентраций (до сорбции) позволяют рассчитать величины сорбции Г для каждого значения концентраций.
Сорбцию (Г,
г/г) рассчитывали по формуле:
![]() (1)
(1)
где С0
и [С] – соответственно исходная
и равновесная концентрации одного из АГП в растворе, моль/дм3; V =10 см3 –
объем раствора, M – молярная масса одного
из АГП, г/моль; m – масса сорбента, г.
В результате проведённых опытов и расчётов были
построены изотермы сорбции различных АГП на УНТ (для примера приведен один
рисунок).
|
|
|
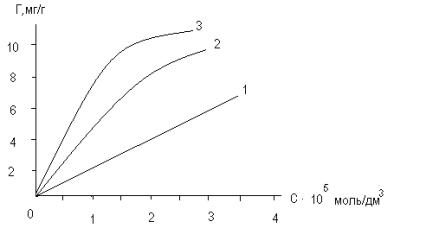
Рис.2. Изотермы сорбции
супрастина на УНТ. 1 - 313±1К,
2 - 298±1К, 3 - 278±1К. |
Предельную сорбцию определяли графическим
решением уравнения Ленгмюра в прямолинейной форме. Для температур 278±1К,
298±1К, 313±1К рассчитали константы
сорбции, а по ним – изменение энтальпии (ΔН) и изобарно-изотермического
потенциала (ΔG) сорбции. Результаты расчетов основных
характеристик сорбции АГП с использованием УНТ приведены в таблице 1.
Таблица 1
Основные
термодинамические характеристики сорбции АГП на УНТ.
Число опытов
n=6, степень
надежности р=0,95, критерий Стьюдента tp=2,57
|
АГП |
Константы сорбции (К) при различных температурах |
-ΔН, кДж/моль |
-ΔG298, кДж/моль |
ΔS, Дж/моль∙К |
Г∞, мг/г |
||
|
К278 |
К298 |
К313 |
|||||
|
Димедрол |
2,05±0,25 |
3,10±0,35 |
4,50±0,50 |
16,25 |
14,20 |
-6,88 |
50,0 |
|
Дипразин |
2,45±0,24 |
3,85±0,42 |
5,25±0,52 |
15,75 |
14,75 |
-3,36 |
55,0 |
|
Димебон |
3,25±0,32 |
4,05±0,41 |
5,15±0,52 |
9,90 |
14,88 |
16,71 |
45,0 |
|
Диазолин |
3,52±0,35 |
4,45±0,50 |
6,35±0,65 |
12,20 |
15,11 |
9,73 |
52,0 |
|
Сетастин |
2,35±0,25 |
3,82±0,39 |
4,50±0,50 |
5,49 |
14,79 |
31,01 |
45,0 |
|
Супрастин |
2,65±0,27 |
3,75±0,38 |
4,85±0,50 |
12,49 |
14,69 |
7,38 |
42,5 |
|
Тавегил |
2,83±0,31 |
3,85±0,40 |
4,95±0,52 |
11,55 |
14,75 |
10,74 |
40,5 |
Как видно из табл. 1, сорбция АГП на УНТ
проходит при очень низких значениях изменения энтальпии, что можно объяснить
тем, что АГП с УНТ не образуют не только ковалентных, но и слабых водородных
связей. Согласно геометрии молекул АГП, возможен вариант внедрения их во
внутреннюю полость УНТ. Этот вариант взаимодействий можно дополнительно
проверить изучением кинетики сорбции АГП на УНТ.
Изучение кинетики сорбции. Изучали время, в течение которого из раствора
поглощаются углеродными нанотрубками АГП, т.е. получили кинетические кривые,
анализ которых позволил определить как реальное время поглощения, так и дать
дополнительные сведения о механизме сорбции.
В колбу емкостью 250 см3 вносили
10 см3 раствора одного из АГП с концентрацией 5∙10-4
М. Отбирали в пробирку около 10 см3 этого раствора. В
оставшийся раствор вносили 10 г сорбента
и включали секундомер, быстро перемешивали, секундомер не выключали в течение
всего эксперимента. Через 30, 60, 90, 120, 150, 180, 210, 240, 300, 600 и 3600
с отбирали по 10 см3 растворов и центрифугировали, отбирали по 5 см3
осветленной фракций, проводили индикаторную реакцию с перманганатом калия и
измеряли оптические плотности растворов при 670 нм в кювете толщиной 2 см
относительно воды. Опыты проводили при температурах 278±1К, 298±1К, 313±1К
(рис. 3).
|
|
|
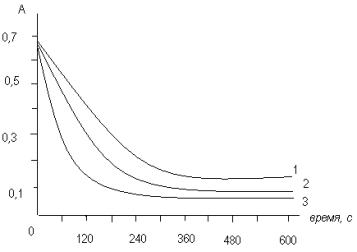
Рис.3.
Влияние температуры на скорость сорбции АГП на УНТ (пояснения в тексте). 1 -
278±1К, 2 - 298±1К, 3 - 313±1К. |
Таблица 2
Основные
термодинамические характеристики кинетики адсорбции АГП на УНТ. Число опытов n=6, степень надежности р=0,95, критерий Стьюдента tp=2,57
|
АГП |
Константа сорбции (К) при различных температурах |
ln PZ0 |
Еакт, кДж/моль |
ΔS#, Дж/моль∙К |
||
|
К278 |
К298 |
К313 |
||||
|
Димедрол |
3,10±0,35 |
5,80±0,60 |
10,20±0,10 |
2,9 |
15,80±1,50 |
105,0 |
|
Дипразин |
3,20±0,35 |
6,10±0,65 |
2,50±0,13 |
3,2 |
16,50±1,70 |
109,5 |
|
Димебон |
3,10±0,32 |
5,20±0,55 |
9,60±0,10 |
3,0 |
10,50±0,18 |
108,5 |
|
Диазолин |
2,85±0,28 |
5,05±0,50 |
11,20±1,0 |
3,2 |
13,15±1,5 |
115,0 |
|
Сетастин |
3,05±0,30 |
6,15±0,63 |
13,50±1,3 |
3,3 |
6,20±0,70 |
120,0 |
|
Супрастин |
3,32±0,35 |
6,17±0,65 |
11,75±0,95 |
3,0 |
12,46±1,30 |
108,5 |
|
Тавегил |
3,10±0,33 |
6,25±0,65 |
12,95±1,35 |
3,2 |
10,75±1,25 |
110,0 |
Анализ результатов изучения кинетики сорбции
АГП на УНТ позволил сделать следующие выводы:
1)сорбция различных АГП на УНТ протекает
очень медленно, по сравнению с сорбцией АГП на других сорбентах, имеющих
активные функциональные группы, такие как гидроксильная, карбонильная,
силанольная, силоксановая и др. [3];
2)УНТ лишены большинства из тех активных
групп, которые характеризуют
энергетические и кинетические характеристики сорбции, что приводит к
образованию устойчивых химических связей;
3)результаты опытов убедительно
свидетельствуют в пользу того, что здесь наиболее удачным было бы использование
термина «число активных соударений». Это надо понимать так, что только удачная
встреча молекул АГП с полостью углеродной нанотрубки может привести к тому, что
молекула АГП сможет проникнуть в эту полость. Близкие значения констант
скоростей сорбции и энергии активации свидетельствуют в пользу того, что
различия в химической структуре молекул АГП мало влияют на скорость сорбции.
Вместе с тем, через достаточно продолжительное время, примерно за 5-6 мин,
основная масса АГП удаляется из раствора углеродными нанотрубками.
4) результаты опытов свидетельствуют в пользу
того, что УНТ являются перспективным материалом для удаления АГП из водных
растворов.
Литература
1.
Машковский, М.Д. Лекарственные средства / М.Д. Машковский. - 14-е изд. перераб., испр. и доп.
М.: ООО «Новая волна», 2004. -
608с.
2.
Суздалев И.П.,
Нанотехнология: Физико-химия нанокластеров, наноструктур и наноматериалов. –
М.: КомКнига, 2006. – 592с.
3. Алыков Н.М., Кутловская
Е.В., Плосконос М.В. Сорбционно-спектрофотометрическое определение некоторых
антигистаминных препаратов // Естественные науки. - 2003. - №6. - С.109-116.