Медицина / 7.
Родионов И.В., д.т.н., проф., член-корреспондент РАЕ
ФГБОУ ВПО «Саратовский государственный
технический университет имени Гагарина Ю.А.», Россия
Статья подготовлена при
поддержке гранта Президента РФ
МК-1799.2011.8.
Оценка влияния антибактериальных
свойств металлооксидных биосовместимых покрытий, содержащих Сu, La и Ag, на приживляемость стержневых ортопедических имплантатов
из нержавеющей стали
Введение
Стержневые имплантаты
из нержавеющей хромоникелевой стали часто применяются в аппаратах внешнего
чрескостного остеосинтеза при травматолого-ортопедическом лечении переломов и
исправлении деформаций различных костей. Имплантаты, выполняемые из нержавеющей
стали, обладают требуемыми механическими характеристиками в условиях действия
функциональных нагрузок, что позволяет обеспечивать жесткость фиксации
аппаратов внешнего остеосинтеза. Однако довольно часто под действием
значительных нагрузок происходит расшатывание аппаратов, связанное с
возникновением макроподвижности имплантатов в костной ткани из-за низкой
прочности их закрепления в кости, что влечет за собой необходимость выполнения
повторной репозиции костных отломков. Высокая прочность закрепления имплантатов
в кости, как правило, достигается за счет формирования на их поверхности открытопористых
биосовместимых покрытий, обладающих способностью интеграционного взаимодействия
с костной тканью. Материалами таких покрытий могут являться кальцийфосфатные
соединения (например, гидроксиапатитовая керамика), углерод, биоинертные
стекла, оксиды некоторых металлов и др. Последние материалы представляют
наибольший практический интерес в виду отсутствия необходимости их отдельного
синтеза для последующего нанесения на изделия, технологической простоты
создания на поверхности имплантатов, а также применения технически несложного и
доступного оборудования.
Получение
металлооксидных покрытий на стальных имплантатах заключается в окислении
поверхности при ее взаимодействии с различными реакционными средами – водными
электролитами и кислородсодержащими газами.
Обработка в газовых
окислительных средах (воздух, перегретый водяной пар, смеси инертных и
реакционных газов) представляется наиболее рациональной при создании покрытий
на имплантатах из нержавеющей стали т.к. предполагает только выдержку изделий в
нагревательном устройстве (печи) с определенной температурой при определенной
продолжительности оксидирования в той или иной газовой среде.
При этом образование покрытия происходит за счет взаимодействия металлической основы с реакционными компонентами рабочей среды (например, кислородом воздуха) при определенной температуре в печи. В результате такого реакционного взаимодействия на обрабатываемой поверхности формируются металлооксидные соединения, которые придают ей комплекс повышенных физико-химических и механических свойств отличных от свойств основного металла. Происходит термоупрочнение модифицированных поверхностных слоев изделий при сохранении химического состава и свойств основной металлической матрицы. За счет термохимических процессов фазообразования осуществляется формирование на поверхности газотермического металлооксидного покрытия без использования дополнительных материалов для получения покрытия.
Авторскими исследованиями было установлено, что покрытия стальных ортопедических имплантатов, созданные различными способами газотермического оксидирования, обладают качествами биосовместимости и способностью интеграционного взаимодействия с костными структурами [1-4].
Однако при использовании
имплантатов как с оксидными покрытиями, так и с другими видами биосовместимых
покрытий нередко происходит воспаление окружающих тканей, что связано с
деятельностью патогенных микроорганизмов в зоне хирургического вмешательства. В
результате это часто является причиной отторжения имплантатов с их последующим
удалением из организма и необходимостью проведения повторной хирургической
операции.
Минимизация
развития микробных агентов в имплантационной зоне достигается использованием
различных антибактериальных препаратов, вводимых в эту зону, как правило,
инъекционно. Однако возможно обеспечение противомикробного действия стальных
имплантатов при модифицировании металлооксидного покрытия медью, лантаном или серебром
– химическими элементами с природными биомедицинскими свойствами, направленными
на подавление деятельности микробной флоры [5].
Модифицирование оксидированных имплантатов может осуществляться электрохимическим способом, предусматривающим катодное внедрение указанных элементов в поверхностно-пористую микроструктуру оксидов при использовании неводных электролитов, содержащих Cu, La или Ag в качестве модифицирующих компонентов.
Поэтому целью работы являлось исследование влияния металлооксидных биосовместимых покрытий, модифицированных Cu, La и Ag, на антибактериальные свойства и приживляемость стальных ортопедических имплантатов.
Методика
проведения исследований
Опытными имплантатами являлись стержневые чрескостные фиксаторы для внешнего остеосинтеза диаметром 2,5 мм и длиной 35 мм, изготовленные путем токарной обработки прутков из биотолерантной нержавеющей стали 12Х18Н9Т.
Поверхность имплантатов-фиксаторов обрабатывалась пескоструйной
обдувкой с использованием абразива Al2О3 дисперсностью
350 мкм для создания исходной микрошероховатой структуры.
После пескоструйной обдувки проводилось ультразвуковое обезжиривание образцов
в моющем растворе 40 г/л Na3РО4 в течение
25-30 мин при частоте ультразвуковых колебаний f=22 кГц и интенсивности W=1,2
Вт/см2. Затем предварительно обработанные образцы промывались в
дистиллированной воде и просушивались в термошкафу при 500С.
Формирование металлооксидного покрытия осуществлялось авторским способом паротермического оксидирования при температуре 5500С и продолжительности 2 ч в условиях подачи перегретого водяного пара при постоянном давлении, составляющим 1,2 атм. Получение покрытий происходило в условиях взаимодействия стальной поверхности с реакционными компонентами парогазовой среды, в результате чего формировались поверхностные металлоксидные системы определенной структуры и толщины.
К числу исследуемых физико-химических и механических характеристик металлооксидных покрытий относились фазовый состав, толщина, шероховатость поверхности, пористость и морфология, микротвердость, адгезия.
Модифицирование полученных покрытий Cu, La и Ag
проводилось способом катодного внедрения в гальваностатическом режиме при
использовании неводных медь-, лантан- и серебросодержащих электролитов. При
этом первая группа оксидированных имплантатов подвергалась модифицированию
поверхности медью, вторая группа – модифицированию поверхности лантаном, третья
группа – модифицированию поверхности серебром.
Присутствие модифицирующих элементов в составе металлооксидных покрытий
определялось методом лазерного эмиссионного микроспектрального анализа на
установке «Спектр-2000». Источником возбуждения спектров являлся лазер на
основе Nb (λ=1,06 мкм), работающий в режиме гигантского импульса с
длительностью 10 нс. Частота следования
импульсов излучения составляла 25 Гц, энергия импульса 120 мДж, плотность мощности
1010-1012 Вт/см2. В качестве диспергирующего
устройства использовался спектрограф ДФС-458С. Диаметр лазерного кратера при одиночном импульсе составлял в среднем
200 мкм, глубина кратера – 150 мкм. Химический состав исследуемой поверхности
определялся на нескольких ее участках по получаемым спектрам элементов.
Апробация стальных имплантатов с металлооксидными покрытиями, модифицированными
Cu, La и Ag, проводилась при испытаниях
in vivo на лабораторных кроликах породы
«черный великан», которым в большеберцовые кости на 50 суток вкручивались
опытные стержневые образцы. Контрольной группой образцов являлись имплантаты с
немодифицированным металлооксидным покрытием.
Клинико-биологическая
оценка антибактериальных свойств покрытий стержневых имплантатов проводилась по
признакам развития
гнойно-воспалительных процессов в зоне введения стержней с использованием микробиологического
исследования мазков экссудата. При этом в зону имплантации дополнительно
вводились микроорганизмы с патогенным потенциалом (гемофильные палочки,
кишечные палочки, золотистый и эпидермальный стафилококк) для
экспериментального повышения микробной активности, усугубления воспалительных
процессов и выявления эффективности антибактериальных свойств покрытий, в
составе которых присутствовали модифицирующие элементы – Cu, La, Ag.
Результаты
и их анализ
Экспериментальное исследование
комплекса характеристик полученных покрытий стальных имплантатов показало, что
в состав оксидированной поверхности, в основном, входят такие фазы как интерметаллид FeNi, оксиды Ti3O5 и Fe3O4. Оксиды Cr и Ni присутствовали в покрытии в
весьма малых, «следовых» количествах, что, вероятнее всего, связано с высокой
жаростойкостью этих элементов, которые активно взаимодействуют с кислородом при
повышенных температурах паротермического оксидирования, превышающих 6000С
(табл.).
Таблица
Характеристики металлооксидных
покрытий, полученных на имплантатах из стали 12Х18Н9Т паротермическим
оксидированием
|
Режим оксидирования |
Характеристики покрытий |
|||||||||
|
рсреды, атм |
t, 0С |
τ, ч |
фазовый состав |
толщина, мкм |
адгезия, МПа |
микротвердость, ГПа |
пористость, % |
Шероховатость, мкм |
||
|
Rа |
Rmax |
Sm |
||||||||
|
1,2 |
550 |
2 |
Fe3O4, FeNi,
Ti3O5 |
55 |
25 |
5,4 |
39 |
1,2-1,3 |
5,4-5,9 |
10-14 |
Установлено, что значения толщины, адгезии и микротвердости, а также
структурно-гетерогенный характер и размерные параметры морфологии полученных
покрытий соответствуют медико-техническим условиям взаимодействия с костной
тканью и способствуют эффективному функционированию имплантатов в кости при их
остеоинтеграционном и высокопрочном закреплении в организме (табл.) [1].
При
электрохимическом модифицировании поверхности оксидированных образцов первой
группы микрочастицами Cu химический (элементный) состав
покрытия соответственно изменялся с учетом присутствия меди, наличие которой
было определено с помощью лазерного микроанализа по спектральным линиям с λ=327.39 нм (рис. 1).
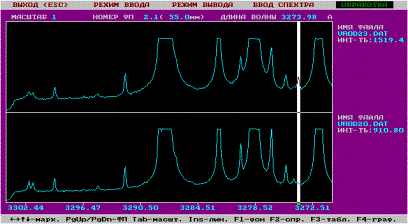
Рис. 1. Спектрограммы 2-х участков поверхности оксидированной стали 12Х18Н9Т, модифицированной Cu (белым атласом обозначены спектральные линии Cu (λ=327.39 нм) с различной интенсивностью в отн. ед., остальные линии принадлежат элементам стали – Fe, Cr, Ni, Ti)
При модифицировании оксидированной поверхности стальных образцов второй
группы лантаном и образцов третьей группы – серебром в химический состав
покрытия соответственно входили данные элементы (рис. 2, 3).
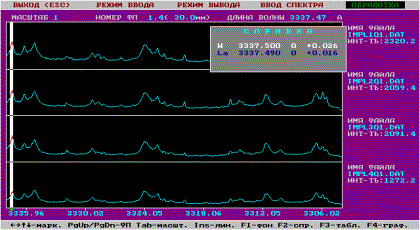
Рис. 2. Спектрограммы 4-х участков поверхности оксидированной стали 12Х18Н9Т, модифицированной La (белым атласом обозначены спектральные линии La (λ=3337,49Å) с различной интенсивностью в отн. ед., остальные линии принадлежат элементам стали – Fe, Cr, Ni, Ti)
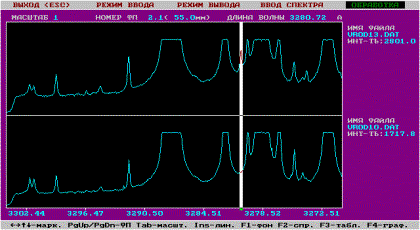
Рис. 3. Спектрограммы 2-х участков поверхности оксидированной стали 12Х18Н9Т, модифицированной Ag (белым атласом обозначены спектральные линии Ag (λ=328.06 нм) с различной интенсивностью в отн. ед., остальные линии принадлежат элементам стали – Fe, Cr, Ni, Ti)
На
всех исследуемых участках покрытий каждой группы образцов модифицирующие
элементы Cu, La и Ag присутствовали примерно в
одинаковых микроколичествах. Это обусловлено, в первую очередь, высокой
равномерностью поверхностного распределения открытых микропор покрытий, в
которые осаждаются микрочастицы элементов. В результате происходит характерное
локальное модифицирование пористой поверхности металлооксидов, что и объясняет близкий уровень содержания того или иного модифицирующего
элемента на различных участках покрытия согласно значениям интенсивностей
спектров (рис. 1-3).
С учетом малых, микронных размеров пор проникновение в
них внедряемого элемента приводит к образованию весьма малого количества
локальных «островковых» агломератов внедренных микрочастиц, соответствующего содержанию
меди, лантана и серебра в модифицированных покрытиях как микроэлементов. Данные
условия внедрения Cu, La и Ag в микроколичествах характеризуются механизмом
катодного процесса обработки, обусловливающим протекание поляризационных
явлений на участках покрытия с наименьшими значениями толщины и электрического
сопротивления оксидов. Такими участками в большинстве случаев являются донные
части открытых пор, где и происходит поверхностная локализация того или иного
применяемого модифицирующего элемента, а также соответствующее изменение
химического состава покрытия.
Было установлено, что образование отдельных микровключений Cu, La или Ag в модифицированных
металлооксидных покрытиях не изменяет существенным образом их исходные
поверхностно-структурные характеристики. Данные
оптической микроскопии свидетельствуют о незначительном изменении морфологии
покрытий, связанном с наличием на поверхности распределенных микроучастков
внедренных элементов. Микрочастицы элементов не покрывают всю поверхность
покрытий, а присутствуют на ней только в виде отдельных участков, ограниченных
микропорами, и распределены преимущественно в соответствии с расположением этих
микропор. Очевидно, что модифицированные медью, лантаном и серебром покрытия
имплантатов не снижают высокого уровня показателей морфологической
гетерогенности поверхности и не утрачивают свою способность к интеграционному
взаимодействию с костной тканью.
Результаты испытаний стальных
имплантатов показали, что оксидированные образцы, не содержащие в составе
покрытия модифицирующих элементов (Cu, La, Ag), функционировали в
условиях высокой активности патогенных микроорганизмов в зоне имплантации, что
сопровождалось опасностью возникновения существенных воспалительных явлений в
окружающих тканях с последующим отторжением имплантатов (табл.).
Образцы, имеющие металлооксидные
покрытия, содержащие Cu, не подвергались риску
отторжения вследствие подавления активности патогенной микрофлоры в отдаленный
период приживления и в результате оказываемого бактериостатического действия Cu в
составе покрытий (табл.).
Образцы с покрытиями, модифицированными
La, проявили биомедицинские свойства, сходные со свойствами
оксидированных образцов, содержащих на поверхности Cu, что способствовало
успешной приживляемости имплантатов, протеканию нормальных остеоинтеграционных
процессов и, как результат – прочной взаимосвязи покрытий с костной тканью
(табл.).
Таблица
Результаты клинико-биологических испытаний стержневых чрескостных имплантатов
из стали 12Х18Н9Т с металлооксидными покрытиями
|
Группа опытных стержневых имплантатов |
Микробиологический анализ мазков экссудата |
Время появления воспаления тканей |
Характер взаимосвязи поверхности имплантатов с костной тканью после испытания |
|
имплантаты с немодифицированным металлооксидным покрытием (контрольная группа) |
высокая микрофлорная активность на начальной стадии, небольшая опухоль тканей |
на 2-е сутки с продолжением воспаления до 7-х суток (3 из 10 образцов функционировали с риском дальнейшего отторжения) |
наличие на поверхности крупных фрагментов новообразованной костной ткани, интегрированной с покрытием |
|
имплантаты с металлооксидным покрытием, модифицированным Cu |
незначительная микрофлорная активность на начальной стадии, которая на более поздних стадиях не повышалась (результат – бактериостатическое действие) |
- |
присутствие тонкого слоя молодой кости, прочно соединенной с поверхностью покрытия |
|
имплантаты с металлооксидным покрытием, модифицированным La |
- |
||
|
имплантаты с металлооксидным покрытием, модифицированным Ag |
незначительная микрофлорная активность в течение 1-3 суток с последующим полным подавлением деятельности патогенных микроорганизмов (результат – бактерицидное действие) |
- |
наличие на поверхности относительно толстого слоя костного регенерата, равномерно интегрированного с покрытием |
Образцы с металлооксидными покрытиями, содержащими микрочастицы Ag, показали
сравнительно наиболее высокий уровень приживляемости при полном подавлении
деятельности патогенных микроорганизмов в зоне имплантации. При этом опасность
отторжения имплантатов была минимальной, а остеоинтеграционная способность
покрытий – наилучшей, о чем свидетельствовало наличие на поверхности образцов
относительно толстого слоя костного регенерата, равномерно интегрированного с
покрытиями (табл.).
Таким образом, в
результате проведенных исследований установлено, что стержневые ортопедические
имплантаты из нержавеющей хромоникелевой стали 12Х18Н9Т с металлооксидными
биосовместимыми покрытиями, модифицированными такими антимикробными химическими
элементами как Cu, La, Ag, обладают не только
способностью эффективного интеграционного взаимодействия с костными
структурами, но и бактериостатическими свойствами при модифицировании
оксидированной поверхности медью либо лантаном, и бактерицидными свойствами при
модифицировании поверхности серебром.
Литература
1. Родионов И.В. Металлооксидные покрытия с
остеокондуктивными свойствами на остеофиксаторах из нержавеющей стали 12Х18Н9Т
/ Материали за VII Международна научна практична
конференция «Научният потенциал на света – 2011». София,
България: Изд-во «Бял ГРАД-БГ» ООД. Т.6. С. 49-55.
2. Патент РФ на изобретение №2412723. Способ получения оксидного биосовместимого покрытия на чрескостных имплантатах из нержавеющей стали / Родионов И.В., Бутовский К.Г., Анников В.В., Карпова А.И. Опубл. 27.02.2011.
3. Родионов И.В. Коррозионные потенциалы различных видов поверхностей стальных ортопедических остеофиксаторов в физиологическом растворе // Коррозия: материалы, защита. №11, 2009. С. 6-10.
4. Родионов И.В. О возможности
получения оксидных биопокрытий на стальных ортопедических имплантатах в
интервале температур воздушно-термического оксидирования 400-7000С /
Маtеriály IV Mezinárodní vĕdecko-praktická konference
«Vĕdecký průmysl evropského kontinentu – 2008». Praha, Czech
Republic: Publishing House «Education and Science» s.r.o. Díl 13 (Chemie
a chemická technologie). S. 17-25.
5. Родионов И.В. Биосовместимые оксидные покрытия с бактерицидными свойствами на медицинских изделиях имплантационного назначения / Маtеriały V Międzynarodowej naukowi-praktycznej konferencji «Nauka i inowacja – 2009». Przemyśl, Polsкa: Nauka i studia. Vol. 10. S. 10-14.