Биологические науки/10. Генетика и цитология
Сережникова
Н.Б.,1 Погодина Л.С.,1 Трофимова Н.Н.,2 Зак П.П.2
Биологический факультет Московского государственного университета имени
М.В. Ломоносова1, Москва, Россия
Институт биохимической физики имени Н.М. Эмануэля РАН2,
Москва, Россия
Влияние коротковолнового видимого
света на клетки ретинального пигментного эпителия японского перепела Coturnix japonica
(электронномикроскопическое
исследование)
Одно из
первых мест в нарушениях зрения занимает поражение сетчатки [1]. При этом
известно, что свет, являясь носителем зрительной информации, одновременно
выступает и как провоцирующий фактор в развитии дегенеративных изменений
сетчатки.
Наибольшую опасность для зрения человека представляет коротковолновая часть синего
диапазона видимого спектра: длины волн 410-480 нм [2]. Вплоть до настоящего времени основное внимание
уделялось исследованию состояния сенсорной части сетчатки, сейчас стало
очевидным, что к световому повреждению более чувствительны клетки ретинального
пигментного эпителия (РПЭ) [2, 3]. РПЭ выполняет многочисленные
высокоспециализированные функции по поддержанию гомеостаза сетчатки,
осуществляя метаболический транспорт между фоторецепторным слоем сетчатки и
капиллярами сосудистой оболочки [4]. Опасное действие
синего света на РПЭ связывают во-первых, с фототоксичностью липофусциновых
гранул («шлаковый балласт», накапливающийся в клетках РПЭ в течение жизни),
которые при облучении запускают реакции свободнорадикального окисления [3, 5], и
во-вторых, с нарушением работы митохондрий этих клеток: подавление
окислительного фосфорилирования [6]. Развивающийся при этом окислительный
стресс приводит к дисфункции клеток РПЭ, их гибели, что впоследствии
драматически сказывается и на функционировании фоторецепторов сетчатки. Предполагают,
что негативное действие света синего диапазона способствует развитию возрастных
изменений и различных заболеваний сетчатки, приводящих к слабовидению и даже к полной потере зрения [2]. В последнее время перспективной
экспериментальной моделью для подобных исследований является мелкая домашняя
птица японский перепел (Coturnix japonica)
[7]. Организм этих животных, включая сетчатку, чрезвычайно быстро стареет – в
пределах одного-полутора лет. Сетчатки перепела и человека имеют значительное
морфологическое сходство и близкий оксикаротиноидный антиоксидантный обмен,
отсутствующий у традиционных лабораторных грызунов, что придаёт дополнительную
привлекательность данной животной модели. Вместе с тем изменения в сетчатке
перепела, в том числе и в РПЭ, после светового воздействия, особенно на
ультраструктурном уровне изучены не в полной мере.
В данной работе с помощью трансмиссионной электронной микроскопии и морфометрического анализа проведено исследование ультраструктурных
изменений РПЭ глаз самок японского перепела возрастом 9, 25, 39-40, 52 и 78
недель при воздействии коротковолнового видимого света: синие светодиоды со спектральной
полосой излучения 430 - 465 нм при дозах 1 - 4 Дж и временем облучения 15 - 60
минут.
A Б
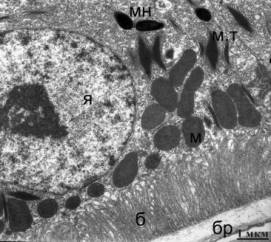
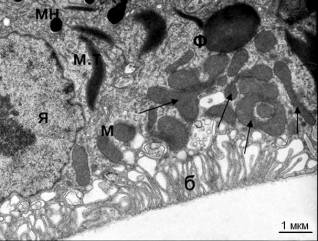
Рис. 1.
Ультраструктура клеток РПЭ сетчатки птиц возрастом 9 недель. (А) Контроль - без
облучения. (Б) После облучения синим светом. Я - ядро; мн -
гранулы меланина; м -
митохондрии; м.т - миелоидные тельца; ф
- фагосома; б - базальная
складчатость плазмалеммы; бр - мембрана Бруха. Стрелками указаны кольцевидные и
гантелевидные митохондрии.
А Б
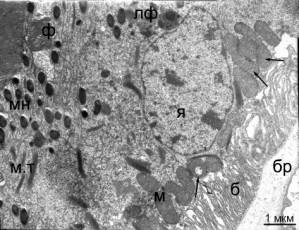
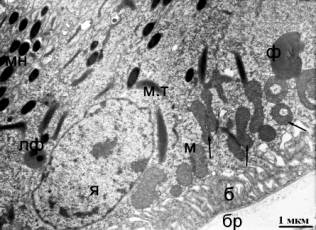
Рис. 2. Ультраструктура клеток РПЭ сетчатки птиц возрастом 25 недель. (А)
Контроль - без облучения. (Б) После облучения синим светом. Я - ядро; мн - гранулы меланина; м
- митохондрии; м.т - миелоидные тельца; ф
- фагосомы; лф - гранулы липофусцина; б - базальная складчатость
плазмалеммы; бр - мембрана Бруха. Стрелками указаны кольцевидные и
гантелевидные митохондрии.
Из наших
данных следует, что при облучении светом фототоксичного синего диапазона выраженные
изменения в ультраструктуре клеток РПЭ происходят у молодых птиц возрастом 9 и
25 недель (рис.1, 2). Они затрагивают прежде всего хондриом этих клеток: в 2
раза возрастает количество митохондрий кольцевидной и гантелевидной формы, в
контроле встречающихся редко. Увеличение числа кольцевидных профилей
митохондрий отмечалось и в клетках РПЭ цыплят, выращенных в условиях
непрерывного освещения [8]. Такие изменения митохондриальной структуры могут
быть проявлением адаптивной реакции хондриома в связи с нарушением работы
митохондрий в результате светового воздействия: известно, что под действием синего
света становятся токсичными изомеры A2Е
(основные флуорофоры липофусцина), высокий уровень которых в клетках РПЭ
приводит к снижению мембранного потенциала митохондрий и подавлению
окислительного фосфорилирования [6].
Кроме
того, в клетках РПЭ молодых птиц после фотооблучения часто встречаются ядра
неправильной формы, с инвагинациями ядерной оболочки. Такое изменение ядер,
приводящее к увеличению площади контакта ядерной поверхности с цитоплазмой,
также может отражать нарушение метаболизма клеток РПЭ и развитие адаптационных
реакций при световом воздействии. В некоторых ядрах, однако, помимо
неправильной формы, отмечалась повышенная конденсация хроматина - подобную
ультраструктуру ядра часто описывают в клетках, находящихся в состоянии
апоптоза [9].
В нашем
исследовании при краткосрочном облучении (от одного часа и менее) не
наблюдалось заметного повышения содержания липофусцина в клетках РПЭ японского
перепела C. japonica.
Однако, по данным литературы [10], более длительное облучение самок перепелов (двукратная 18-часовая световая экспозиция) приводит к 30%-му
повышению количества липофусциновых гранул в центральной зоне сетчатки спустя
полтора месяца после облучения. Эти различия в результатах по накоплению
липофусциновых гранул, по нашему мнению, показывают, что метаболические
процессы формирования липофусциновых гранул достаточно медленны по времени.
Также при
действии коротковолнового видимого света не изменялась внутренняя структура и
форма характерных для клеток РПЭ птиц миелоидных телец, присутствие которых
связывают с процессами фагоцитоза [11]; однако, облучение молодых птиц
приводило к примерно 30%-му снижению их удельного объёма, а у птиц возрастом 25
недель - ещё и к снижению их численности. Эти результаты, по-видимому,
свидетельствуют о снижении фагоцитарной активности клеток РПЭ после светового
воздействия.
Вместе с
тем мы отметили негативное влияние синего света на состояние базальных
отростков клеток РПЭ молодых птиц: после
облучения они становились более редкими и менее упорядоченными (рис. 1 Б,
2 Б). В мембране Бруха после
фотооблучения наблюдалось увеличение содержания везикулярных, гранулярных,
линейных и пластинчатых включений. Эти проявления дисфункции клеток РПЭ
после светового воздействия, по-видимому, могут приводить к замедлению и нарушению
транспорта веществ между сосудистой оболочкой и РПЭ.
У птиц
более старшего возраста значительных изменений в ультраструктуре клеток РПЭ
после фотооблучения выявлено не было, что, возможно, связано со снижением их
адаптационных возможностей при старении.
В целом, из
наших данных следует, что кратковременные
воздействия коротковолнового видимого света на глаза молодых перепелов влияют
на состояние хондриома, ядер, численность
миелоидных телец в клетках РПЭ, а также на структуру мембраны Бруха. Полученные
результаты подтверждают возможность использования японского перепела в качестве
хорошей модели для изучения в ускоренном временном режиме функционального
состояния РПЭ при фотоповреждении и дают дополнительную систему тестов, позволяющую
на ультраструктурном уровне оценить степень развития возрастных процессов в
зависимости от световой нагрузки.
Литература:
1.
Трофимова С. В., Хавинсон В. X.
Сетчатка и старение // Успехи геронтологии. 2002. № 9. С. 79-82.
2.
Algvere P.V., Marshall J., Seregard S.
Age-related maculopathy and the impact of blue light hazard // Acta Ophthalmol. Scand. 2006. Vol.
84. № 1. P. 4-15.
3.
Островский М.А.
Фотобиологический парадокс зрения // Успехи биологической химии. 2005. Т. 45. С.
173-204.
5. Schutt F., Davies S., Kopitz J., Holz F.G., Boulton M.E.
Photodamage to human RPE cells by A2-E, a retinoid component of lipofuscin // Invest. Ophthalmol. Vis. Sci. 2000. Vol. 41. № 8. P. 2303-2308.
6. Vives-Bauza C., Anand M., Shirazi A.K., Magrane J., Gao J., Vollmer-Snarr H.R., Manfredi G., Finnemann S.C.
The age lipid A2E and mitochondrial dysfunction synergistically impair
phagocytosis by retinal pigment epithelial cells // J. Biol. Chem. 2008.
Vol. 283. № 36.
P. 24770-24780.
7.
Зак П.П., Зыкова А.В., Трофимова Н.Н., Абу Хамидах А.Е., Фокин А.И., Эскина Э.Н., Островский М.А. Экспериментальная модель для исследования механизмов возрастных и
дегенеративных изменений в сетчатке глаза человека (японский перепел C.japonica) //
ДАН. 2010. Т. 434. № 2. С. 272-274.
8.
Lauber J.K. Retinal pigment
epithelium: ring mitochondria and lesions induced by continuous light //
Curr. Eye. Res. 1982-1983. Vol.
2. № 12. P. 855-862.
9. Лушников Е.Ф., Абросимов Ф.Ю. Гибель клетки (апоптоз). Москва: Медицина. 2001. 190 с.
10. Fite K.V., Bengston
L., Donaghey B. Experimental light damage increases lipofuscin in the retinal pigment epithelium of Japanese quail (Coturnix japonica)
// Exp. Eye. Res. 1993.
Vol.
57. № 4. P. 448-453.
11. Dickson D.H., Harvey H.L.
Myeloid body development in the chick retinal pigment epithelium // Curr. Eye.
Res. 1992. Vol. 11. № 2. P. 147-152.