И.В.
Манжуло, О.С. Огурцова, И.В. Дюйзен
Федеральное
государственное бюджетное учреждение науки Институт биологии моря им. А.В.
Жирмунского ДВО РАН, Россия
Аналгетический эффект докозагексаеновой кислоты у крыс с моделью нейрогенного болевого синдрома
В эксперименте на белых крысах показано, что перевязка
седалищного нерва сопровождается развитием нейропатического болевого синдрома –
у животных снижается порог температурной болевой чувствительности, формируется
неравномерное распределение веса на задние конечности, а также возникают
дистрофические нарушения в тканях стопы. Использование докозагексаеновой
кислоты у животных с повреждением седалищного нерва дозо-зависимо (и в большей
мере, чем препарат сравнения диклофенак) снижает активность и сроки реализации
нейрогенного болевого синдрома, приводит к более ранней стабилизации
распределения веса и препятствует развитию дистрофических изменений в тканях
стопы.
Ключевые
слова:
докозагексаеновая кислота, нейропатический болевой синдром, крысы.
Введение
Проблема терапии нейропатической боли на
сегодняшний день является объектом пристального изучения во всем мире.
Последние исследования в этой области предлагают несколько методик,
направленных на борьбу с нейрогенными болевыми синдромами [4]. Одно из
направлений лечения нейропатической боли основано на роли полиненасыщенных
жирных кислот (ПНЖК) в нервной ткани. Показано, что жирные кислоты этой группы
способны оказывать прямое стабилизирующее воздействие на мембрану клеток, делая
ее более устойчивой к повреждающим воздействиям, с одной стороны, и более
податливой для проведения нервного импульса – с другой [6].
Кроме того, действие ПНЖК в нервной ткани
опосредуется влиянием на синтез, метаболизм, везикулярный транспорт и
рецепторные эффекты нейротрансмиттеров, нейромодуляторов и сигнальных молекул. Полиненасыщенные
жирные кислоты могут непосредственно или косвенно модулировать неврологическую
активность на различных уровнях [5]. Значительный интерес представляет докозагексаеновая
кислота (ДГК), выраженные антиболевые эффекты которой были зарегистрированы на некоторых
моделях острой боли [1, 12]. В настоящем исследовании мы определяли особенности
реализации антиболевого эффекта ДГК у крыс с моделью хронической нейропатической
боли.
Материалы и методы
Работа выполнена на самцах крыс средним весом 250
г., содержащихся в стандартных условиях вивария. Исследование проводили в
соответствии с Правилами проведения работ и использования экспериментальных
животных (Приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Животных содержали
в виварии в соответствии с «Санитарными правилами по устройству, оборудованию и
содержанию экспериментально-биологических клиник» (от 06.04.1993 г.). Животные
получали стандартную диету (корм для лабораторных мышей и крыс ЗАО «БиоПро»)
следующего состава: протеин (21.5%), клетчатка (4%), метионин + цистеин (0.8%),
Ca (1%), P (0.4%), NaCl
(0.35%), калорийность не менее 13.2 МДж/кг.
Для моделирования нейропатического болевого
синдрома под эфирным наркозом проводили наложение 3 лигатур на седалищный нерв [3].
Животные были разделены на пять групп (по 8 животных в каждой) – группа «контроль»,
группа «боль» - с моделью нейропатической боли, группа «ДГК45» - животные с
травмой, получающие ДГК в дозе 45 мг/кг, группа «ДГК4.5» - животные с травмой,
получающие ДГК в дозе 4.5 мг/кг и группа «диклофенак» - животные с травмой,
получающие 4мг/кг диклофенака (Indus Pharma Pvt. Ltd., India) - препарат
сравнения. Все препараты вводили внутримышечно в течение 2 недель после
операции.
Развитие болевого синдрома у животных с
поврежденным периферическим нервом сопровождается появлением ряда
патологических симптомов, поддающихся количественной оценке и свидетельствующих
об интенсивности боли. Мониторинг патологических изменений осуществляли с
использованием специализированного оборудования. Распределение нагрузки на
задние конечности исследовали с помощью тестера инвалидности (Columbus Instruments, USA). Данный тест позволяет оценить выраженность
болевого синдрома в поврежденной лапе по характеру распределения веса на задние
конечности при неподвижном положении животного в камере наблюдения [13]. Данные
о распределении веса на правую и левую конечности (в граммах) выражали в процентах
от общего веса животного. У интактных животных этот показатель находится в
пределах 50:50%, а развивающийся при повреждении периферического нерва болевой
синдром сопровождается уменьшением нагрузки на поврежденную конечность. Hot-cold-plate-анализатор (Columbus Instruments, USA) использовали в настоящем исследовании для оценки
холодовой аллодинии, неизменно сопровождающей развитие нейрогенного болевого
синдрома [3]. Тест проводили в камере с акриловыми стенами высотой 30 см на
охлажденной до 0оС металлической пластине размером 30х30 см.
Интактные животные в течение длительного времени способны выдерживать данную
температуру, опираясь всеми конечностями на охлажденный пол. При повреждении
нерва время контакта конечности с холодной пластиной значительно сокращается.
Для количественной оценки данного параметра регистрировалось время удержания
конечности на весу в течение 1 минуты пребывания животного в тест-камере. Все
функциональные тесты проводились на 5, 9, 13, 17 сутки после операции; каждое животное
тестировалось трижды с интервалом в 5 минут между измерениями. Полученные
данные обрабатывали с использованием пакета программ “Statistica 6.0”. Достоверность различий (при р<0.05)
оценивали по t критерию Стьюдента.
Результаты
В тесте распределения нагрузки на задние
конечности у животных с нейропатическим болевым синдромом возникает асимметрия
в удержании веса тела с более активным использованием интактной конечности [13].
Данный показатель в разные послеоперационные сроки имел достоверные отличия у
животных всех экспериментальных групп. Животные в группе «боль» уже через 5
суток после повреждения нерва 69.9±1.8% собственного веса удерживали интактной
конечностью. В этот же период животные группы «ДГК45» распределяют вес практически
симметрично (55.4±2%:44.6±2%) с предпочтительным использованием неповрежденной
лапы, в группе «ДГК4.5» - 70.7±1.57%:29.3±1,57%, а в группе «диклофенак» - 66.4±2.36%:33,6±2.36%.
В дальнейшем у животных всех групп формируется тенденция к снижению
доминирования упора на здоровую конечность, к концу эксперимента распределение
веса у животных группы «боль» составляет 65.3±2.4%:34.7±2.4%, в группе «ДГК45»
животные полностью восстанавливают баланс распределения веса, тогда как
распределение веса в группе «ДГК4.5» и «диклофенак» составляет 61.4±2%:38.6±2%
и 56.6±2.35%:43.4±2.35% соответственно (Рис. 1).
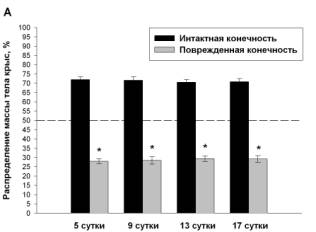
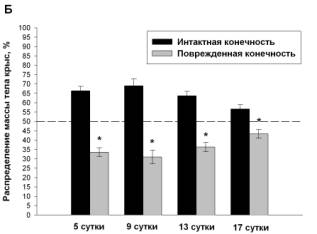
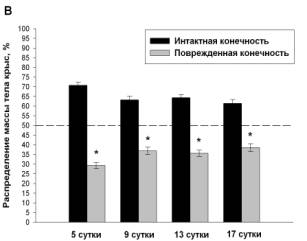
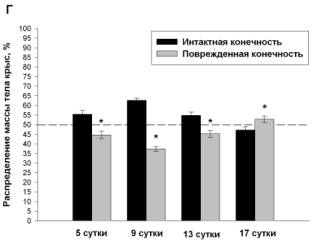
Рис. 1 Динамика распределения веса на задние
конечности у животных с моделью нейропатической боли (А), при использовании диклофенака
(4 мг/кг) (Б), ДГК (4.5 мг/кг) (В) и ДГК (45 мг/кг) (Г), пунктир – контроль.
Данные представлены как M±m, %, где m – стандартная ошибка среднего.
*Достоверные различия между значениями интактной и поврежденной конечности (p<0.05).
Развитие холодовой аллодинии характеризует наличие и степень
развития нейрогенного болевого синдрома и основывается на феномене снижения
порога возбуждения рецепторов на воздействие неболевых термических стимулов [3].
Результаты проведенного теста в группе «боль» демонстрируют появление данного
синдрома уже на 5 сутки после операции (8.5±0.39 секунд) и его резкое нарастание к 9-13 суткам.
Лишь к концу наблюдения отмечалась тенденция к снижению этого показателя до 14.75±0.61 секунд. У животных
группы «ДГК45» начальные признаки развития холодовой аллодинии регистрировались
позже - на 9 сутки (9±1.31
секунд), и
сохранялись на данном уровне вплоть до конца наблюдения, тогда как у животных
группы «ДГК4.5» аллодиния отсутствовала. В группе «диклофенак» признаки
аллодинии возникали уже на 5 сутки, и нарастали к 13-17 дню наблюдения (Рис. 2).
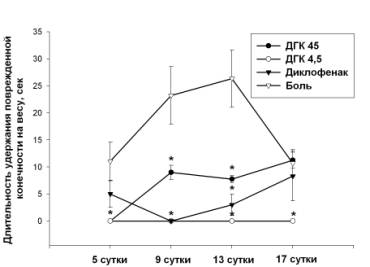
Рис. 2 Выраженность холодовой аллодинии (время отсутствия
контакта с охлажденной пластиной) у животных при повреждении седалищного нерва
и использовании диклофенака (4 мг/кг), ДГК (4.5 мг/кг), ДГК (45 мг/кг). Данные
представлены как M±m, секунд, где m – стандартная ошибка среднего. *Достоверные
различия между значениями группы «боль» и животными групп «ДГК45», «ДГК4.5» и
«диклофенак» (p<0.05).
Также необходимо отметить, что у 60% крыс из группы «боль» за
период наблюдения были выявлены признаки обширных трофических повреждений стопы
и явление аутотомии одного или нескольких пальцев травмированной конечности. У
животных групп «ДГК45», «ДГК4.5» и «диклофенак» описанных патологических
изменений не наблюдалось. Зарегистрированные на 6-10 сутки незначительные
изъязвления кожи поврежденной лапы, спонтанно рубцевались и эпителизировались.
Обсуждение
В настоящее время механизмы нейропротективного и
антиболевого эффектов ДГК активно исследуются. Наиболее широко изучены
антивоспалительные и антиоксидантные эффекты препарата [1, 4], приводящие к
уменьшению инициирующего боль воспалительного процесса в периферических тканях.
Кроме того, ДГК, встраиваясь в мембраны нейронов и глиальных клеток, модулирует
их метаболические, электрические и рецепторные свойства [2]. Эндогенные метаболиты
ДГК (нейропротектин D1 и резолвины) уменьшают выраженность некроза и апоптоза тканевых
элементов центральной и периферической нервной системы [10, 11, 15]. ДГК
является основным компонентом фосфолипидов мембран нейронов, где выполняет
структурную и функциональную роль [7]. Состояние мембран нейронов имеет
решающее значение для передачи нейрональной информации и ионного обмена между
внутренней и внешней сторонами мембраны [14]. На сегодняшний день известно, что
комплексы жирных кислот отдельных регионов мозга в разной степени страдают от
недостатка ДГК в процессе развития [10]. Последние данные указывают на то, что
в дополнении к описанным эффектам ДГК оказывает нейропротекторное воздействие
на нервную ткань при хронических дегенерационных процессах [5]. Проведены
исследования, результаты которых демонстрируют тот факт, что использование ДГК
после травмы спинного мозга значительно повышает выживаемость нейронов и
улучшает локомоторные и двигательные функции [8]. В спектре эффектов ДГК
выявлены также специфические нейротрансмиттерные взаимодействия, обеспечивающие
подавление болевого сигнала – уменьшение продукции вещества Р ноцицептивными
нейронами (собственное неопубликованное наблюдение) и активация эндогенных
опиоидных [12] и неопиоидных [9] механизмов аналгезии. Детальное изучение
особенностей и механизмов антиболевого действия эссенциальных полиненасыщенных
жирных кислот необходимо для разработки новых фармакологических стратегий
регуляции болевого синдрома.
Исследование выполнено при поддержке
Министерства образования и науки Российской Федерации, соглашение
14.132.21.1344 и ДВО РАН, гранты 12-III-А-06-090; 12-I-П7-02; 13-III-В-06-020; 13-III-В-06-035.
Литература:
1.
Bazan N.G. // Curr. Opin. Clin.
Nutr. Metab. Care. 2007. Vol. 10. P. 136-141.
2.
Belayev L., Marcheselli V.L.,
Khoutorova L. et al. // Stroke. 2005. Vol. 36. P. 118-123.
3.
Bennett G.J. // Muscle Nerve. 1993.
Vol. 16. P. 1040- 1048.
4.
Cunnane S.C., Plourde M., Pifferi F.
et al. // Prog. in Lipid Res. 2009. Vol. 48. P. 239-256.
5.
Dyall S.C., Michael-Titus A.T. //
Neuromol. Med. 2008. Vol. 10. P. 219-235.
6.
Farooqui A.A., Horrocks L.A.,
Farooqui T. // J. Neurochem. 2007. Vol. 101. P. 577-599.
7.
Gamoh S., Hashimoto M., Sugioka K.,
Hossain M., Hata N., Misawa Y., Masumura S. // Neuroscience. 1999. V. 93. P. 237-241.
8.
King V.R.,
Huang W. // The J. of Neurosci. 2006. V.26. № 17. P. 4672-4680.
9.
Mathieu G., Denis S., Langelier B.
et al. // Neurochem. Int. 2010. Vol. 56. P. 94-100.
10.
Mukherjee P.K, Chawla A., Loayza
M.S. et al. // Prostagland. Leuk. Essent Fat. Ac. 2007. Vol. 77. P. 233-238.
11.
Nakamoto K., Nishinaka T. et al. //
Biol. Pharm. Bull. 2010. Vol. 33, № 6. P. 1070-1072.
12.
Nakamoto K., Nishinaka T. et al. //
Europ. J. of Pharm. 2011. Vol. 666. P. 100-104.
13.
Nakazato-Imasato E., Kurebayashi Y.
// Life Scienc. 2009. Vol. 84. P. 622-626.
14.
Rodriguez T., Belayev E.B., Liu L.,
Busto Y., Parkins R., Bazan N. // J. of Neurochem. 2002. V. 83. P. 515-524.
15.
Serhan C.N., Gotlinger K., Hong S.
et al. // J. Immunol. 2006. Vol. 176. P. 1848-1859.