Химия и химические технологии/4. Химико-фармацевтическое производство
Тимофеева
А.В.1, Ильина М.В4., Иванова В.Т.4,
Сапурина И.Ю.3,
Баратова
Л.А.1, Катруха Г.С.2
1НИИ
ФХБ имени. А.Н.Белозерского, МГУ имени. М.В. Ломоносова,
г. Москва, Россия
2ФГБУ
НИИ
по изысканию новых антибиотиков им. Г.Ф. Гаузе РАМН,
г. Москва,
Россия
3 Институт
высокомолекулярных соединений РАН,
г.
Санкт-Петербург, Россия
4 ФГБУ НИИ вирусологии им.
Д.И.Ивановского Минздравсоцразвития России, г. Москва, Россия
Исследование процессов сорбции и
десорбции
антибиотиков разных групп на
многослойных углеродных
нанотрубках типа «Таунит».
Известно, что антибиотики в процессе биосинтеза образуются в незначительных количествах и в культуральной жидкости (КЖ) штамма-продуцента находятся в сложной многокомпонентной смеси вторичных метаболитов и питательной среды. Выделение антибиотиков из КЖ штамма-продуцента – всегда сложная аналитическая, химическая и технологическая задача, которая требует новых методических подходов и, в частности, - внедрения в практику новых эффективных адсорбентов. С этой целью мы исследовали возможность использования многослойных углеродных нанотруб (МУНТ) для адсорбции из растворов ряда практически важных антибиотиков, а также процесс их десорбции с МУНТ. В качестве адсорбента был выбран новый носитель - МУНТ типа «Таунит» (рис.1) с конфигурацией «матрешка», разработанный и полученный в «ООО НаноТехЦентр», г. Тамбов (Россия) [1]. Конфигурация «матрешка» имеет вид коаксиально вложенных друг в друга однослойных цилиндрических нанотрубок (Рис.2 [2]), которые представляют собой частицы диаметром 40-80 нм и длиной до 10 мкм с удельной площадью поверхности 60-100 м2/г и остаточным содержанием катализатора около 1% веса. [3]. Углеродные нанотрубы получают методом каталитического пиролиза углеводородов. При этом используется катализатор в виде наночастиц магнитных металлов или их сплавов. В данном случае для синтеза нанотруб использовали магниево-итриевый катализатор с размером частиц 3-5 нм [3].

Рис.1 Электронная сканирующая микроскопия
многостенных углеродных нанотруб типа «Таунит» [1]. Репер в правом нижнем углу имеет размер 1 мкм.
Рис.2 Многостенные
углеродные нанотрубы в форме «матрешка» [2].
Для
исследования возможности сорбции/десорбции антибиотиков на МУНТ типа «Таунит»
мы в качестве модельных соединений выбрали следующие практически важные
антибиотики: бацитрацин, блеомицетин, блеомицетин- Fe2+-, грамицидин S, гризеовиридин, левомицетин, линкомицин, пенициллин G, полимиксин В, тейкопланин А2,
теломицин и этамицин А. [4]
Комплексы типа антибиотик-наносорбент получали в статических условиях путем добавления к навеске (5,0 мг) сорбента «Таунит» 600 мкл водного раствора антибиотика, концентрацией 0,2 мг/мл с последующим выдерживанием суспензии «Таунит»-антибиотик в течение 18 час. при 18-200С. По окончании сорбции раствор антибиотика отделяли от сорбента центрифугированием на микроцентрифуге фирмы BECKMANCOULTER ™ Microfuge® 18 Centrifuge (США) в течение 5-7 мин. при 11894g.
Количество антибиотиков в растворе до сорбции и после сорбции определяли методом обращеннофазной высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ) на микроколоночном хроматографе Милихром А-02”(ЗАО «Эконова», г. Новосибирск, Россия) [5] с колонками из нержавеющей стали размером (2.0×75,0 мм), заполненными сорбентом Nucleosil 100-5C18 РАН фирмы «Macherey-Nagel» (Германия). Колонки термостатированы при 35°С. Реагенты готовили, используя воду высшей степени очистки (18.1 Мом/см), полученную на установке Milli-Q®Plus «Millipore» (Франция); ацетонитрил для ВЭЖХ фирмы «Sigma-Aldrich» (Германия). Для анализа готовили растворы антибиотиков в воде с концентрацией 0,2 – 3,0 мг/мл. Объем вводимой пробы составлял 5-15 мкл. Детекцию разделяемых веществ осуществляли при двух длинах волн - 214 и 280 нм. Время ОФ ВЭЖХ анализа - 25 мин. для каждого из анализируемых препаратов антибиотиков. В работе использовали линейный градиент подвижной фазы, создаваемый элюентом А (0.1% раствор трифторуксусной кислот (ТФУ) в воде) и элюентом В (0.1% раствор ТФУ в ацетонитриле). Полученные хроматограммы оценивали с помощью компьютерной программы МультиХром–СПЕКТР для Windows 9х &NT версия 1,5х-Е («Амперсенд», Россия).
В ходе исследования было установлено, что в разработанных нами условиях выбранные для изучения сорбционных свойств «Таунита» антибиотики разных химических групп (см. выше) сорбируются на «Тауните» и, таким образом, могут быть полностью удалены из содержащих их растворов.
При разработке условий десорбции с «Таунита» описанных выше антибиотиков мы использовали полученные нами ранее данные по сорбции/десорбции антибиотиков с наносорбента УДУС [6]. Во внимание принимали также литературные по свойствам и структуре матрицы сорбента «Таунит». Известно, что «Таунит» является гидрофобным материалом [1], очистку которого от металлического катализатора проводят смесями сильных неорганических кислот (серная+азотная). В результате такой очистки на поверхности труб, а также на их торцах образуется небольшое количество полярных группировок –COOH, -OH, -SO3H, -NH2. [7]. Следовательно, при адсорбции антибиотиков из растворов на «Таунит» возможны как гидрофобные взаимодействия антибиотика с «Таунитом», так и вполне вероятно образование ионных связей между полярными группами, образующимися на поверхности «Таунита», с различными функциональными группами (-СОOH, -NH2 и др.) антибиотиков. Учитывая особенности строения «Таунита», для полной десорбции антибиотиков в состав элюирующих смесей мы вводили следующие органические растворители - тетрагидрофуран (ТГФ), ацетонитрил (АСН), этиловый спирт (ЭС) и 0.5М уксусную кислоту (УК), которая необходима для снятия ионных взаимодействий типа антибиотик-сорбент.
Для десорбции антибиотиков с МУНТ к комплексу «Таунит»-антибиотик, полученному при выдерживании в течение 18 ч суспензии 5,0 мг сорбента и 0,6 мл раствора антибиотика, концентрацией 0,2 мг/мл, добавляли 600 мкл элюирующей смеси. Полученную суспензию встряхивали вручную в течение 2-3 мин. По окончании десорбции МУНТ отделяли от элюирующей смеси центрифугированием (см. методику выше). Десорбцию антибиотиков проводили в трехкратной повторности. Общий объем элюирующей смеси равен 1,8 мл. Величину десорбции определяли методом ОФ ВЭЖХ по возрастанию содержания антибиотика в суммарном элюате и выражали в %-х от количества сорбированного антибиотика. (см. Таблицу 1)
Таблица 1. Выход антибиотиков после десорбции с «Таунита» при использовании различных элюирующих смесей.
|
Название антибиотика |
Классификация антибиотиков |
Мол. масса, Да |
Элюирующая смесь |
Выход антибиотика после десорбции,% |
|
|
Бацитрацин |
Циклический полипептид |
1422.69 |
ТГФ-АЦН-0.5М УК (12:25:63) |
50.0 |
|
|
Блеомицетин |
Гликопептид |
1415.55 |
ТГФ-АЦН-0.5М УК (6:10:84) |
50.0 |
|
|
Блеомицетин-Fe2+ |
Гликопептид |
1471.55 |
ТГФ-АЦН-0.5М УК (6:25:69) |
65.0 |
|
|
Грамицидин S |
Циклодекапептид |
1140.71 |
ТГФ-ЭС-0.5М УК (20:50:30) |
65.0 |
|
|
Гризеовиридин |
Депсипептид |
477.53 |
нет |
Не десорбируется (н/д) |
|
|
Левомицетин |
Ароматический антибиотик |
323.123 |
ТГФ-АЦН-0.5М УК (6:25:69) |
95.0 |
|
|
Линкомицин |
Линкозамид |
406.54 |
ТГФ-АЦН-0.5М УК (6:20:74) |
80.0 |
|
|
Пенициллин G |
β-лактамный
антибиотик |
334.39 |
нет |
н/д |
|
|
Полимиксин В |
Пептид - циклопептид |
1301.56 |
нет |
н/д |
|
|
Тейкопланин А2 |
Гликопептид |
1877.66 |
ТГФ-ЭС- 0.5М УК (20:50:30) |
95,5 |
|
|
Теломицин |
Пептидолактон |
1272.32 |
нет |
н/д |
|
|
Этамицин |
Пептидолактон |
879.12 |
нет |
н/д |
|
В таблице 1 представлены элюирующие смеси, при использовании которых выход антибиотика после десорбции с «Таунита» был максимальным. Из таблицы 1 следует, что степень десорбции некоторых антибиотиков с «Таунита» варьирует в диапазоне 65-95%, а такие антибиотики как этамицин, гризеовиридин и пенициллин G практически не десорбируются с нанотрубок «Таунит». Данные таблицы 1 свидетельствуют также о том, что для некоторых антибиотиков (тейкопланин А2, грамицидин S) использование элюирующих смесей с повышенным содержанием (в количественном соотношении) органических растворителей, приводит к увеличению их выхода, тогда как для других антибиотиков (линкомицин, левомицетин, блеомицетин-Fe2+.) десорбция с «Таунита» увеличивается при повышении в элюенте количества 0.5 М уксусной кислоты. В то же время изменение соотношения гидрофобных (органические растворители) и полярных компонентов (0.5М уксусная кислота) в элюирующих смесях не приводит к существенной десорбции с «Таунита» антибиотиков типа гризеовиридина, этамицина, теломицина и пенициллина G.
На основании полученных результатов возможно предположить, что адсорбция антибиотиков гидрофобной группы (например, тейкопланина А2 и грамицидин S) на МУНТ осуществляется преимущественно по гидрофобному типу взаимодействия, а других, отнесенных к полярной группе - линкомицина, левомицетина, блеомицетина, блеомицетина-Fe2+ - проходит, в основном, по механизму образования ионных связей. Можно полагать, что слабая десорбция с «Таунита» антибиотиков, содержащих как полярные, так и гидрофобные группы (гризеовиридин, этамицин, теломицин, пенициллин G) объясняется более сложным механизмом взаимодействия этих антибиотиков с матрицей «Таунита», требующем дальнейшего изучения.
В ходе работы с «Таунитом» мы провели также исследование сорбционной способности некоторых антибиотиков в зависимости от их исходной концентрации в диапазоне от 0.2 (0.5) до 3мг/мл. Количество МУНТ во всех опытах равнялось 5 мг. Исследование проводилось с антибиотиками, обладающими достаточно высоким выходом при элюции с сорбента, а именно - линкомицином, левомицетином, блеомицетином, блеомицетином-Fe2+ и грамицидином S. Полученные результаты представлены в виде изотерм адсорбции (рис.3). Как следует из графика, адсорбция всех антибиотиков первоначально возрастает и достигает своего максимума при использовании антибиотиков с исходной концентрацией 1.6 мг/мл. С увеличением концентрации антибиотика адсорбция либо снижается (у левомицетина и тейкопланина А2), либо резко падает (у грамицидина S). Интересно отметить, что у антибиотиков блеомицетина-Fe2+ и линкомицина адсорбция с ростом исходной концентрации, наоборот, существенно возрастает.
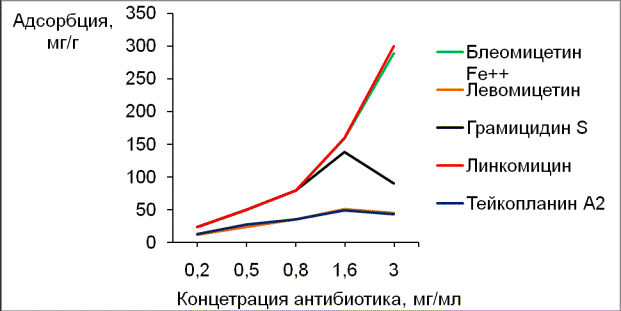
Рис. 3. Изотермы адсорбции антибиотиков
Снижение сорбционной способности по мере роста начальной концентрации антибиотика, по-видимому, связано с понижением растворимости и агломерацией молекул антибиотика в растворе. В ходе агломерации блокируются основные сорбционные центры молекулы, что влечет за собой снижение связывания с углеродными нанотрубами. Наиболее явно тенденция к самоагломерации выражена для грамицидина S.
Резкое увеличение адсорбции блеомицетина-Fe2+возможно обусловлено присутствием в молекуле иона металла Fe2+, который, образуя хелатный комплекс с антибиотиком, связывает
неподеленные электронные пары у большинства функциональных NH2-групп, входящих в состав молекулы антибиотика [4]. В несвязанном
состоянии NH2
-группы значительно повышают
гидрофильность молекулы антибиотика блеомицетина [4], и тем самым препятствуют его
абсорбции на гидрофобную поверхность «
Таунита». (рис.4)
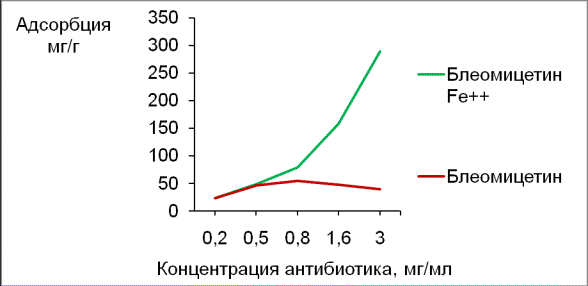
Рис. 4 Изотермы адсорбции антибиотиков
блеомицетина и блеомицетина-Fe2+
Для антибиотика линкомицина увеличение адсорбции, вероятно, связано с тем, что он является по химической природе оснóвным антибиотиком [8], и поэтому его сорбцию на «Таунит» проводили из водно-щелочных растворов с рН 9,0-9.5. Известно, что после кислотного окисления нанотрубы покрываются мелкими остатками (обломками) углеродных частиц, которые необходимо отмывать щелочными растворами. [9] Таким образом, происходит их очистка, и возможно, поэтому увеличивается сорбционная способность «Таунита». Поскольку линкомицин сорбируется на «Таунит» из щелочных растворов, можно предположить, что параллельно сорбции идет процесс очистки сорбента, и вследствие этого увеличивается адсорбция линкомицина на «Таунит».
Выводы:
Впервые изучена возможность использования нового современного наноматериала - многослойных углеродных нанотрубок (МУНТ) типа «Таунит» - для сорбции из растворов практически важных антибиотиков: бацитрацина, блеомицетина, блеомицетина-Fe2+, грамицидина S, гризеовиридина, левомицетина, линкомицина, пенициллина G, полимиксина В, тейкопланина А2, теломицина и этамицина, а также исследована их способность десорбироватся с МУНТ «Таунит». Установлено, что в определенных условиях (избыток МУНТ, 18 ч, 200С) антибиотики способны полностью сорбироваться на «Тауните».
Показано, что на интенсивность связывания (адсорбцию) антибиотиков с нанотрубками, а также на выход антибиотиков после десорбции с «Таунита» существенно влияют соотношения полярных и гидрофобных свойств каждого антибиотика, которые, в свою очередь, зависят от структуры молекулы; а именно - от наличия двойных (двойных сопряженных связей), остатков непредельных циклических фрагментов (ароматических колец фенольного и бензольного типа), функциональных групп, несущих заряд или содержащих неподеленную электронную пару (-NO2, -NH2, OH-групп), присутствие в молекуле катионов металлов и т.д.
Некоторые из полученных результатов требуют более детального изучения, поэтому эти исследования будут продолжены в наших лабораториях для того, что бы в будущем нанотрубки типа «Таунит» можно было использовать как для выделения антибиотиков из культуральной жидкости штаммов-продуцентов, так и для перспективного применения комплексов нанотрубки-антибиотик в качестве медицинских препаратов.
Литература:
1.Мищенко С.В. Углеродные наноматериалы. Производство, свойства, применение. /Мищенко С.В., А.Г. Ткачев. // М. Машиностроение. – 2008. – № 2. – С. 17 – 21.
2.Еременко А.С. Исследование углеродных волокон и углеродных нанотрубок. / Еременко А.С., Власов А.И. // Двенадцатая научная конференция «Шаг в будущее- Москва 2009» Доклады на тематической секции кафедры ИУ4 МГТУ им. Н.Э Баумана.– 2009. (IU4.BMSTU.RU)
3. Сапурина И.Ю. Нанокомпозиты со смешанной и протонной проводимостью для применения в электрокатализе. / Сапурина И.Ю., Компан М.Е., Забродский А.Г., Стейкал Я., Трахова М. // Электрохимия – 2007. – Т.43. - №5. – С. 554-562.
4.
The Merck Index. An encyclopedia of chemicals, drugs, and biological. Te nth
edition. Martha Windholz, Editor. Published by Merck & Co., Inc. Rahway, N.Y.,
U.S.A., 1983.
5.
ЭкоНова: HI-TECH в аналитическом приборостроении.
// Technopolis XXI.- 2005.-№ 2 (www.econova.ru).
6.
G.S. Katrukha, A.V. Timofeeva, V.N. Buravtsev, I.V. Tolsykh, L.A. Baratova // Advances in Medicine and
Biology. Volume 50 Chapter 3: Novel Ultradispersed Carbon-Containing Adsorbent.
The Examples of the Study of Some Glycopeptide Antibiotics Sorption Properties on
the Sorbent. Nova Science Publishers
Inc (USA) 14 august 2012 pp. 43-66.
7.
Раков Э.Г. Химия и применение углеродных нанотрубок // Успехи химии. – 2001. – Т.
70(10). – С. 939.
8. Кожыбски Т., Ковшык-Гиндифер 3.. Курылович В., Антибиотики. Происхождение, природа и свойства, т. 1-2, Варшава, 1969. с. 117-121;
9. Раков Э.Г. Химия и применение углеродных нанотрубок // Успехи химии. – 2001. – Т. 70(10). – С. 937.