Химия и химические
технологии/5. фундаментальные проблемы создания
новых материалов и технологий
Проф.,
д.ф.-м.н. Максимов С.К.1, к.ф.-м.н. Максимов К.С.2
1.
Национальный исследовательский университет МИЭТ. 2. ФГУП «ВИМИ».
Метод выходного контроля в технологиях
наночастиц.
По определению Европейской комиссии от 18.10.2011 наноматериалами являются
композитные материалы, наноразмерные составляющие которых независимо их доли в
составе композита определяют негативное воздействие композита в целом на
процессы в биосфере. Опасность наночастиц связана не только с токсичностью компонентов,
входящих в их состав, но также с их каталитической активностью [1].
Каталитическая активность наночастицы зависит от структуры и огранки (габитуса)
частицы [2]. В наномире размер, структура и габитус термодинамически
взаимосвязаны, и изменение размера частицы вызывает изменения структуры и
габитуса. Начиная с размера ≈ 30 нм, в композициях возникают частицы со
структурно-морфологическими параметрами отличными от таковых у их микронных
аналогов [3]. Не существует технологий формирования частиц только одного размера.
В США монодисперсными считаются, напр., частицы размерами 50 ÷ 70 нм [4]. При нормальном распределении в таком
массиве на 1 г приходится ≈ 1012 частиц средней плотности с размером
в 30 нм, 109 – в 20 нм и 107
– в 10 нм. В одном и том же процессе, в один и тот же момент могут возникать
частицы с разными структурой, габитусом и каталитической активностью. Опасность
генерации наноразмерных частиц присуща всем технологиям, но с освоением
нанотехнологий в медицине и фармакологии, открывающим наночастицам дороги в
организм, риски освоения частиц с непредсказуемыми свойствами катастрофически
растут [5].
Термодинамика определяет возможность структурно-морфологических переходов,
но их реализация зависит от кинетических факторов: как технологических, так и
случайных [6]. Только адекватный выходной контроль обеспечивает совместимость
производства с биосферой и потому является неотъемлемой частью любой
технологии. В силу кинетических факторов, нарушающих связь между размером и
структурой/габитусом, контроль, основанный исключительно на контроле размеров, не
обеспечивает безопасность в биосфере [2].
Прерогатива контроля всего комплекса структурно-морфологических характеристик
принадлежит просвечивающей электронной микроскопии (ПЭМ) и растровой
электронной микроскопии (РЭМ). Дифракционные режимы, встроенные в ПЭМ и РЭМ,
позволяют восстановить структуру, обзорные микрофотографии могут использоваться
для характеризации массивов, состав частиц контролируется посредством
локального рентгеноспектрального анализа [7,8] Однако интегральные электронограммы
массивов дают информацию только о частицах, доля которых в массиве превышает 10-4
[7,8]. Для персонификации структуры отдельных частиц необходимо
интерпретировать их собственные дифрактограммы, что для массивов > 104
не реально. Современное компьютерное обеспечение позволяет персонифицировать
изображения практически неограниченного числа частиц. Габитус однозначно связан
со структурой, но частицы с идентичной структурой могут иметь разные габитусы
[3]. Поэтому контроль габитуса может быть положен в основу выходного контроля [9,10].
Изображения в ПЭМ отвечают проекции объекта на плоскость наблюдения.
Изображения в РЭМ суть проекция объекта на плоскость подложки. Для восстановления
трехмерной формы объекта в ПЭМ и РЭМ используется стереомикроскопия [7,8]. Контраст
на ПЭМ изображениях имеет дифракционный характер и зависит от ориентации и
размеров частицы, что многократно увеличивает вариативность изображений и
усложняет использование стерео методов [7].
РЭМ контраст зависит только от формы частицы и её ориентации относительно
направления освещающего пучка электронов[8]. Поэтому РЭМ изображения массива
частиц позволяют классифицировать эти изображения на основе трех характеристик:
размер, форма и контраст. РЭМ имеет также другие преимущества, делающие его
перспективным в качестве инструмента выходного контроля при массовом
производстве наночастиц. Во-первых, РЭМ ориентирован на контроль морфологии на
площадях до десятков сантиметров, что позволяет инспектировать массивы частиц,
практически неограниченных по численности. Во-вторых, он ориентирован на
компьютерные методы извлечения и обработки информации, что обеспечивает
упрощенное и быстрое развитие методов выходного контроля, независящего от
мастерства операторов. В-третьих, РЭМ обладает высокой скоростью перемещения
электронного луча при формировании изображений, что обеспечивает производительность
достаточную для организации выходного контроля на его основе. В-четвертых, РЭМ
может быть обеспечен детекторами для регистрации электронограмм «на просвет» [8].
Возможность использования РЭМ
для выходного контроля зависит от наличия методов, обеспечивающих реконструкцию
габитуса объекта на основе особенностей изображений.
В РЭМ используют зонды с углами сходимости χ ≤ 10-3 рад, и глубиной фокуса γ ≥ 0,5 мкм, превышающей
высоту нанообъекта [8], (достаточная глубина фокуса или ДГФ). Поэтому размеры освещенной точки (пробы) при движении по
поверхности объекта практически постоянны. Но при χ ≈ 10−1 рад глубина фокуса γ падает до ≤ 10 нм,
становясь меньшей высоты объекта (недостаточная глубина фокуса или НеДГФ), и проба дефокусируется даже при
сканировании объектов высотой в 10 – 20 нм. При движении по поверхности трехмерного
объекта размер дефокусировки, именуемой габитусной, изменяется и соответственно
изменяется размер пробы. Воздействие на объект пробы, размеры которой
изменяются при движении по поверхности объекта, характеризуются кривой воздействий.
Все закономерности для кривой воздействий сохраняют силу для описания
трехмерного распределения интенсивности. Кривая воздействий описывается выражением [9]:
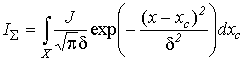 , где
, где ![]() (1)
(1)
δ – полурадиус пробы, равный ![]() , где σ – средне квадратичное отклонение,
IΣ – кривая
воздействий, xc –
координата центра пробы, J –
суммарная интенсивность зонда, z – расстояние
точки на поверхности объекта от выходной плоскости объективной линзы, f – фокусное расстояние, σ0 – радиус сечения
зонда плоскостью фокусировки, R –
радиус выходного отверстия объективной линзы, |z – f| суть высота
объекта, X – область интегрирования,
определяемая протяженностью объекта вдоль данного направления. В силу зависимости
δ от |z – f| кривая воздействий
отражает форму объекта, и в силу δ
=
, где σ – средне квадратичное отклонение,
IΣ – кривая
воздействий, xc –
координата центра пробы, J –
суммарная интенсивность зонда, z – расстояние
точки на поверхности объекта от выходной плоскости объективной линзы, f – фокусное расстояние, σ0 – радиус сечения
зонда плоскостью фокусировки, R –
радиус выходного отверстия объективной линзы, |z – f| суть высота
объекта, X – область интегрирования,
определяемая протяженностью объекта вдоль данного направления. В силу зависимости
δ от |z – f| кривая воздействий
отражает форму объекта, и в силу δ
= ![]() программное
обеспечение, развитое для моделирования РЭМ изображений, (напр. Joy’s PC Monte
Carlo programs,), применимо для операций с кривой воздействий [9,10].
программное
обеспечение, развитое для моделирования РЭМ изображений, (напр. Joy’s PC Monte
Carlo programs,), применимо для операций с кривой воздействий [9,10].
Реакции объекта на
воздействия идентичны, если идентичны сами воздействия. Размер пробы при ДГФ постоянен, и размеры проб при ДГФ и НеГДФ совпадают только в плоскости НеДГФ фокуса [9].
Разностная кривая,
отвечающая разности ДГФ и НеДГФ кривых воздействий, описывается
выражением::
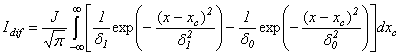 (2) где δi отвечает НеДГФ изображению и δ0
– ДГФ картине. Выражение (2)
может стать основой восстановления габитуса объекта по разностным профилям интенсивности.
Idif = 0 в плоскости НеДГФ фокусировки.
(2) где δi отвечает НеДГФ изображению и δ0
– ДГФ картине. Выражение (2)
может стать основой восстановления габитуса объекта по разностным профилям интенсивности.
Idif = 0 в плоскости НеДГФ фокусировки.
Если первоначальная фокусировка для
изображения, формируемого в условиях НеДГФ,
приходится на плоскость подложки, а за тем объект перемещается с тем, чтобы
фокусировка пришлась на сечение объекта, удаленное от подложки на известное
расстояние, то профили НеДГФ и ДГФ пересекутся в плоскости этого сечения
(Рис.1).
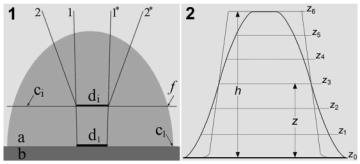
Рис.1. Определение
габитуса объекта путем сочетания НеДГФ и ДГФ изображений. Рис. 1-1. объект и условия реализации
метода определения габитуса. b
– подложка, a –
объект, ci – плоскость НеДГФ фокусировки, 1 – 1* – образующие ДГФ пучка, 2 – 2* – образующие НеДГФ
пучка.d1 – размер ДГФ пробы, di – размер пробы в плоскости фокусировки, f – точка пересечения контура объекта плоскостью НеДГФ фокусировки. Рис. 1-2.
профили интенсивности и реализация метода. z0 – плоскость подложки, zi –
виртуальные плоскости НеДГФ фокусировки,
z3 – реальная плоскость НеДГФ фокусировки, z –
расстояние от подложки, h – высота объекта.
Методы, основанные на сопоставлении НеДГФ и ДГФ изображений,
могут быть реализуемы при постоянном угле сходимости. В этом случае в РЭМ формируются
три плоскости: основная, являющаяся плоскостью фокусировки, и две боковых, на
которых поочередно располагается объект. Особенности этой методики
характеризуются рисунком 2.
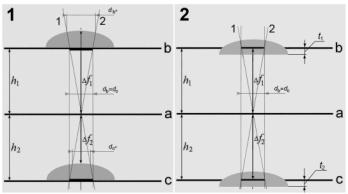
Рис. 2.
Реализация
метода при одном угле сходимости и разных плоскостях локализации объекта. а –
плоскость фокусировки. в, с – плоскости
локализации объекта. h1, h2 – расстояния плоскостей локализации от плоскости фокусировки, h1 = h2, ∆fi –
дефокусировки, di – размеры проб.
Существующее программное обеспечение, напр., SEMLP, позволяет точно рассчитать изображение
объекта, но обратная задача не реализуема, поскольку неизвестны z-координаты отдельных точек на изображении [7].
Подходы, характеризуемые рис. 1, 2, решают задачу определения z-координат и позволяют восстанавливать точный
габитус объекта посредством существующего программного обеспечения.
После восстановления габитусов объектов,
контроль структуры упрощается: эта процедура необходима только для частиц с
разными габитусами, и число операций по определению структуры уменьшается на много
порядков [9,10].
Операции по определению
структурно-морфологических характеристик
наночастиц могут быть совмещены со стадией отработки технологии, когда
устанавливаются связи между РЭМ изображениями (опорными изображениями) и
структурно-морфологическими характеристиками частиц разных типов. В результате
выходной контроль на стадии производства осуществляется посредством
сопоставления изображений частиц, сформированных в данном конкретном
производственном процессе, с опорными изображениями [9,10].
1.
Documents
of the European Commission, http://ec.europa.eu/environment/
chemicals nanotech/.
2. S. Zuin, G. Pojana and A. Marcomini,
“Effect-oriented physicochemical characterization of nanomaterials,” In: N.
Montairo-Riviere, L. C. Tran Eds. Eds., Nanotechnology.
Characterization, Dosing and Health Effects. Informa Healthcare USA, Inc,
2007, pp. 19-58.
3.
A. Barnard. Progress in Physics, 2010. V. 73, No 8, art.
86502 (52).
4.
S.M. Kauzlarich, R.K. Baldwin. Method for preparing
group IV nanocrystals with chemically accessible surfaces. US patent 7,267,721. 2007.
5.
J.Z. Wen, C.F. Goldsmith, R.W.
Ashcraft, W. H. Green. Detailed kinetic modeling of iron nanoparticle synthesis
from the decomposition of Fe(CO)5, J. Phys. Chem. C, v. 2007,
111, No 15, pp. 5677–5688..
http://web.mit.edu/greengp/papers/detailed kinetic
modeling of iron.pdf.
6. Bio-Applications of Nanoparticles
(Advances in Experimental Medicine and Biology). Chan W C.W. (Editor) //
Springer. 2010. 287 p.
7. D. B. Williams, C.B. Carter: “Transmission Electron Microscopy. A Textbook for Materials Science”. Springer. 2009. 774 p.
8. Goldstein J., Newbury D., Joy D., et al. Scanning Electron Microscopy and X-Ray Microanalysis. Kluwer
Acad. & Plenum Publ. 2005. N.Y. USA. 663 p.
9. Maksimov
S.K., Maksimov K.S., Soukhov N.D. Safety in large-scale manufacturing of nanoparticles
for bio-medical use. // Emerging Materials Research, 2012. V. 1. No 2.
PP. 49–60.
10. Maksimov S.K.,
Maksimov K.S., Soukhov N.D. As Could We
Assure Safety in Large Scale Manufacturing of Nanoparticles for Biomedical
Applications. Journal of Biomaterials
and Nanobiotechnology, 2011. 2. PP. 477-489.