К.х.н. Пожидаева С.Д., аспиранты Макеева
Т.В., Сотникова Д.А., Елисеева А.Ю.,
д.х.н. Иванов А.М.
Юго-Западный государственный университет, Россия
Использование
средней за определенное время скорости расходования металла в качестве оценки
его эффективности как восстановителя в гетерогенном взаимодействии с металлсодержащими
окислителями
В практике оценки
коррозионного поражения металла или сплава, да и в ряде других случаев, часто
пользуются величиной средней за некоторое время скорости, выраженной количеством
в граммах или молях израсходованного металла (сплава), отнесенных к единице
массы или поверхности их в единицу времени [1]. И это вполне понятно, поскольку
эта характеристика является одной из самых достоверно и легко получаемых.
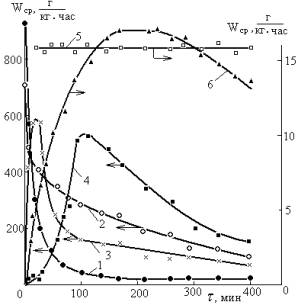
Вместе с тем, как следует из рис. 1, она далеко не
|
|
Рис. 1. Изменение средней скорости расходования
металла (сплава) во времени протекания процесса при гетерогенном его
окислении соединением меди (II)
в водном растворе (суспензии) кислоты в присутствии стимулирующей добавки при
естественно складывающейся температуре: 1- медь (45% от массы мольной загрузки),
уксусная кислота (0,75 моль/кг), молекулярный йод (0,25 моль/кг), бисерная
мельница с высокооборотной мешалкой (1560 об/мин); 2 – бронза (35%), хлорид
меди (II) (0,22), HCl (2,6), корпус бисерной мельницы с мешалкой
(3000); 3 - медь (30), оксид меди (II)
(0,8), уксусная кислота (2,0), хлорид алюминия (0,31), бисерная мельница с
высокооборотной мешалкой (3000); 4 –цинк, оксид меди (II) (0,1), муравьиная кислота (3,2), хлорид
алюминия (0,25), бисерная мельница с высокооборотной мешалкой (1440); 5- медь
(11), оксид меди (II)
(2,04), HCl (0,7), хлорид бария
(0,1), механический встряхиватель 2 Гц ; 6 – условия п.5, хлорид алюминия
(0,1) |
всегда является объективной. Так
из кривых 1 и 2 следует, что чем больше время использовано для определения
средней скорости, тем меньше ее величина, причем различия могут достигать не
только в десятки, но и в сотни раз. Еще сложнее в случае кривых 3, 4, 6, где
средняя скорость по времени проходит через максимум. Правда, не исключены
случаи, когда средняя скорость остается примерно постоянной (кривая 5 рис.1), а
иногда и несколько растет.
Причин указанных неувязок несколько и в
каждом конкретном случае они в разных качественных комбинациях и количественных
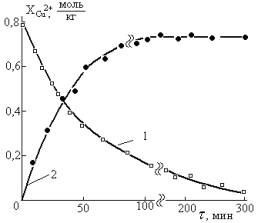
соотношениях. Одна из них связана с кинетикой изменения содержания окислителя.
Последний может интенсивно расходоваться в начальном периоде развития процесса
(кривая 1 рис. 2), что будет способствовать быстрому снижению локальной скорости
расходования металла (сплава). Во втором, содержание реального окислителя (кривая
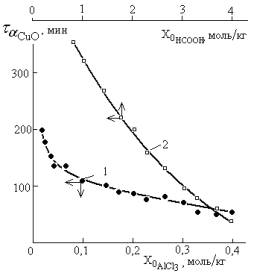
2 рис. 2) какое-то время растет, достигает максимума, близкого к предельному
значению, зависящего от условий проведения (рис. 3), а следовательно синхронно
с этим увеличивается и скорость расходования металла.
|
|
|
|
Рис. 2. Накопление соединений меди (II) при взаимодействии 0,8 моль/кг Cu(OH)2
(анализом не определяется) с 2 моль/кг соляной (1) и уксусной (2) кислотами в
присутствии 30% от массы остальной загрузки раздробленной меди в бисерной
мельнице с высокооборотной мешалкой (1560 об/мин) |
Рис. 3. Время практически количественного превращения
оксида меди (II) во взаимодействии с
металлической медью (30% от массы остальной загрузки) и кислотой в
зависимости от начального содержания AlCl3 в
растворе (1 - |
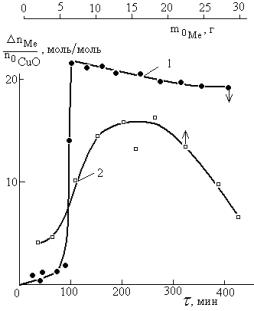
Третий вариант
предполагает участие окислителя в циклической стадии типа
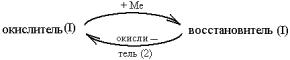 ,
,
где окислитель (I) – металлсодержащее соединение,
вводимое в систему специально или
образующееся из оксида (гидроксида) металла в состоянии высшей валентности во
взаимодействии с компонентом(ами) реакционной системы; восстановитель (I) – продукт(ы) взаимодействия окислителя (I) с металлом; окислитель (II) – чаще всего кислород воздуха, доступ которого в
систему должен быть не ограничен. Количественной характеристикой такой стадии
может быть величина ![]() (n – число молей) (рис. 4). Если такая система вышла на
устойчивый стационарный режим функционирования, она вполне может обеспечить
стабильные скорости расходования металла/
(n – число молей) (рис. 4). Если такая система вышла на
устойчивый стационарный режим функционирования, она вполне может обеспечить
стабильные скорости расходования металла/
|
|
Рис. 4. Количество израсходованных цинка (1) и
алюминия (2) на 1 моль оксида меди (II)
при их взаимодействии в водном растворе муравьиной кислоты во времени
протекания процесса (1) и в зависимости от начальной дозировки металлов в
бисерной мельнице с высокооборотной мешалкой (1440 об/мин); 1 – загрузка
металла 10% от массы остальной загрузки; |
Вторая группа причин связана с состоянием
поверхности металла, в частности с величиной рабочей (т.е. не занятой поверхностными
отложениями продуктов) [2 - 4] поверхности. В сравнении с физической последняя
может быть очень малой (рис. 5) и составлять в лучшем случае небольшие
проценты, а то и доли процента. К тому же плотность и скорость нарастания их
зависит от многих факторов, в частности, состава реакционной смеси и природы
реагентов в них, формы и степени раздробленности поверхности металла, гидродинамической
обстановки в зоне реакции и т.д.
Сказанное выше приводит
к выводу о целесообразности снимать кинетику расходования металла и на основе
полученных кинетических кривых находить динамику изменения скорости
расходования металла во времени.
|
|
|
|
1 |
2 |
|
Рис.5 Фотографии поверхности
чистой меди (1) и с поверхностными отложениями (2) в системе медь-оксид меди
(II)- азотная кислота, полученные с помощью сканирующего электронного микроскопа (JSM-6610LV) |
|
1. Никольский, Б.П.
Справочник химика в 6 томах и дополнит. Том V. Сырье и продукты промышленности неорганических
веществ. Процессы и аппараты. Коррозия. Гальванотехника. Химические источники
тока. / Б.П. Никольский, О.Н. Григоров, М.Е. Позин [и др.]. М.-Л.: Химия. 1968. 976 с.
2. Иванов, А.М. Использование бисерной мельницы для
предотвращения и преодоления самопрекращения окислительно-восстановительных и
иных процессов с участием оксидов переходных металлов и практические решения на базе такого подхода/ А.М. Иванов, С.Д.
Пожидаева. Курск: из-во КурскГТУ, 2008. 316 с.
3.
С. Пожидаева, А. Иванов. Жидкие
фазы в реакциях металлов с кислыми реагентами и окислителями. Deutschland/Германия: изд.
LAP LAMBERT Аcademic Publishing, Saarbrücken. 2012. 353 с.
4. Иванов, А.М.
Макрокинетика химических процессов в исследованиях и технологической практике. Ч. II. Гетерогенные гетерофазные химические процессы/ А.М.
Иванов: Курск: Изд-во ЮЗГУ, 2010. 210 с.