Химия и химические технологии/8. Кинетика и катализ
К.х.н. Рахматуллин Р.Р.
Казанский
национальный исследовательский технологический университет,
Россия
Кинетика реакции Мейера на примере
взаимодействия
арсенита натрия с
галогеноуксусными кислотами
Реакция Мейера
является наиболее
важным и общим методом синтеза алкиларсоновых кислот и осуществляется при
взаимодействии арсенитов щелочных металлов в водных и водно-спиртовых средах с
галогенпроизводными предельных и непредельных углеводородов, карбоновых кислот,
спиртов, кетонов [1], но механизм этой реакции практически не изучен. Сведения
о кинетике реакции Мейера ограничены лишь работой [2], в которой исследовано
взаимодействие мышьяковистой кислоты в водном растворе едкого натра с
3-хлор-1,2-пропандиолом и показано, что реакция имеет первый порядок по
арсенит-иону. В настоящей работе исследована кинетика взаимодействия арсенита
натрия с хлор-, бром- и
иодуксусными кислотами в водном
растворе гидроксида натрия. Выбор в качестве субстрата галогеноуксусной кислоты
основывался на её хорошей растворимости в водно-щелочной среде и высокой
реакционной способности в реакции Мейера [1].
![]() As033- +
HlgCH2COO-
k -OOCCH2As(O)O2-2 +
Hlg-
As033- +
HlgCH2COO-
k -OOCCH2As(O)O2-2 +
Hlg-
I II III
Изучаемая реакция осложнена щелочным
гидролизом галогеноуксусных кислот
![]() HO- +
HlgCH2COO-
kг HOCH2COO- +
Hlg-
HO- +
HlgCH2COO-
kг HOCH2COO- +
Hlg-
Кинетика взаимодействия
арсенита натрия (I) с галогеноуксусными кислотами исследовалась
при 15, 25, 35 и 45![]() в водном растворе
гидроксида натрия. Контроль за ходом реакции осуществлялся как по скорости
расходования арсенит-иона иодометрическим титрованием, так и по скорости накопления
иона галогена аргентометрическим титрованием проб реакционной массы. Скорость
процесса описывается кинетическим уравнением (1).
в водном растворе
гидроксида натрия. Контроль за ходом реакции осуществлялся как по скорости
расходования арсенит-иона иодометрическим титрованием, так и по скорости накопления
иона галогена аргентометрическим титрованием проб реакционной массы. Скорость
процесса описывается кинетическим уравнением (1).
W= kcIcHIg + kгcHIgcNaOH (1)
Здесь W –
скорость накопления иона галогена; k – константа скорости
взаимодействия соединения (I) с галогеноуксусной
кислотой; kг – константа скорости
щелочного гидролиза соответствующей галогеноуксусной кислоты; cI,
cHIg, cNaOH – текущие концентрации
арсенита натрия, галогеноуксусной кислоты и гидроксида натрия соответственно.
Константа скорости взаимодействия соединения (I) с галогеноуксусной
кислотой рассчитывалась по уравнению (2).
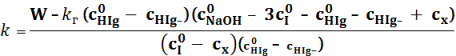 (2)
(2)
Здесь , ![]() ,
, ![]() - начальные концентрации арсенита натрия,
галогеноуксусной кислоты и гидроксида натрия соответственно; cHIg-, cx
– текущие концентрации образующихся галогенид-ионов и аниона
карбоксиметиларсоновой кислоты (III) соответственно.
Скорость реакции W определялась по углу наклона касательной в
каждой точке апроксимированной кривой зависимости текущей концентрации
галогенид-иона от времени. Для определения константы скорости реакции Мейера k
необходимо знать величину константы скорости щелочного гидролиза
галогеноуксусных кислот kг. Поэтому, первоначально
была изучена кинетика щелочного гидролиза хлор-, бром- и иодуксусной кислот при 15,25,35 и 45
- начальные концентрации арсенита натрия,
галогеноуксусной кислоты и гидроксида натрия соответственно; cHIg-, cx
– текущие концентрации образующихся галогенид-ионов и аниона
карбоксиметиларсоновой кислоты (III) соответственно.
Скорость реакции W определялась по углу наклона касательной в
каждой точке апроксимированной кривой зависимости текущей концентрации
галогенид-иона от времени. Для определения константы скорости реакции Мейера k
необходимо знать величину константы скорости щелочного гидролиза
галогеноуксусных кислот kг. Поэтому, первоначально
была изучена кинетика щелочного гидролиза хлор-, бром- и иодуксусной кислот при 15,25,35 и 45![]() . Контроль за ходом реакции осуществлялся аргентометрическим
титрованием образующегося галогенид-иона. Константы скорости щелочного
гидролиза рассчитывались по уравнению второго порядка [3] и приведены в табл.
1.
. Контроль за ходом реакции осуществлялся аргентометрическим
титрованием образующегося галогенид-иона. Константы скорости щелочного
гидролиза рассчитывались по уравнению второго порядка [3] и приведены в табл.
1.
Таблица
1
Константы скорости щелочного гидролиза галогеноуксусных кислот
|
T, oC |
CICH2COOH |
BrCH2COOH |
ICH2COOH |
|
kг л/(моль |
kг л/(моль |
kг л/(моль |
|
|
15 25 35 45 |
0.650 1.83 5.45 16.0 |
29.0 92.1
282
770 |
13.9 43.3
109
257 |
На основе средних величин констант
скорости щелочного гидролиза галогеноуксусных кислот kг по уравнению (2)
рассчитаны константы скорости реакции Мейера k, которые приведены в
табл. 2.
Таблица 2
Кинетические данные
реакции арсенита натрия (I) с хлоруксусной,
бромуксусной и иодуксусной кислотами в водном растворе гидроксида натрия
|
Температура реакции, оC |
моль/л |
моль/л |
моль/л |
Продолжительность реакции, c |
Конверсия, % |
k л/(моль |
|
Хлоруксусная кислота |
||||||
|
15 |
0.2001 |
29.97 |
1.700 |
198 |
6.75 |
1.58 |
|
15 |
0.1991 |
29.96 |
1.7000 |
198 |
9.04 |
1.58 |
|
25 |
0.1141 |
29.98 |
1.2322 |
270 |
12.31 |
2.35 |
|
25 |
0.1941 |
30.20 |
1.7000 |
180 |
13.73 |
2.52 |
|
25 |
0.1952 |
29.93 |
1.7000 |
180 |
15.72 |
2.50 |
|
25 |
0.2333 |
30.01 |
1.4824 |
270 |
15.64 |
2.58 |
|
25 |
0.2361 |
45.02 |
1.4776 |
288 |
18.42 |
2.35 |
|
25 |
0.3449 |
30.00 |
1.8098 |
252 |
19.53 |
2.49 |
|
25 |
0.3612 |
44.98 |
1.8458 |
216 |
22.11 |
2.42 |
|
35 |
0.1961 |
29.93 |
1.7000 |
180 |
27.04 |
4.24 |
|
35 |
0.1991 |
29.95 |
1.7000 |
180 |
27.46 |
4.24 |
|
45 |
0.1916 |
29.94 |
1.7000 |
162 |
38.38 |
9.92 |
|
45 |
0.1921 |
29.91 |
1.7000 |
162 |
39.85 |
10.2 |
|
Бромуксусная кислота |
||||||
|
15 |
8.874 |
15.05 |
0.8663 |
144 |
62.3 |
42.93 |
|
15 |
8.764 |
15.00 |
0.8663 |
144 |
63.2 |
43.52 |
|
15 |
9.440 |
14.77 |
0.8648 |
108 |
45.6 |
47.90 |
|
25 |
8.766 |
14.70 |
0.8663 |
126 |
75.7 |
70.77 |
|
25 |
8.752 |
14.99 |
0.8273 |
126 |
74.3 |
87.52 |
|
35 |
4.441 |
7.537 |
0.4332 |
54 |
26.7 |
166.4 |
|
35 |
8.553 |
15.01 |
0.8648 |
108 |
47.6 |
172.6 |
|
45 |
4.382 |
7.435 |
0.4332 |
108 |
47.7 |
304.7 |
|
45 |
4.460 |
7.549 |
0.4332 |
72 |
42.1 |
249.0 |
|
Иодуксусная кислота |
||||||
|
15 |
5.724 |
7.412 |
0.4250 |
180 |
43.2 |
65.60 |
|
15 |
6.006 |
7.464 |
0.4250 |
180 |
45.4 |
75.32 |
|
25 |
5.805 |
7.720 |
0.4250 |
108 |
62.0 |
147.5 |
|
25 |
6.606 |
7.711 |
0.4250 |
180 |
69.7 |
156.4 |
|
35 |
5.730 |
7.711 |
0.4250 |
162 |
82.5 |
386.6 |
|
35 |
5.955 |
7.772 |
0.4250 |
162 |
83.2 |
529.8 |
|
45 |
6.006 |
7.584 |
0.4250 |
180 |
85.0 |
1078 |
|
45 |
5.868 |
7.512 |
0.4250 |
162 |
84.6 |
898.3 |
Примечание. а) Средние значения k![]() 105 для хлоруксусной, бромуксусной и иодуксусной
кислот при 15,25,35 и 45
105 для хлоруксусной, бромуксусной и иодуксусной
кислот при 15,25,35 и 45![]() соответственно равны
1.58, 2.46, 4.24, 10.1; 44.78, 79.14, 169.5, 276.8; 70.46, 152.0, 458.2, 988.2.
соответственно равны
1.58, 2.46, 4.24, 10.1; 44.78, 79.14, 169.5, 276.8; 70.46, 152.0, 458.2, 988.2.
На основе средних величин констант
скорости щелочного гидролиза галогеноуксусных кислот kг и реакции Мейера k рассчитаны энергия активации E,
кДж/моль, энтропия активации –ΔS, Дж/(град.•моль) щелочного гидролиза кислот: для хлоруксусной
81.7, 89.1; бромуксусной 84.0, 49.4;
иодуксусной 73.7, 89.7; и реакции Мейера: для хлоруксусной 46.9, 182; бромуксусной 47.6, 153;
иодуксусной кислот 68.9, 75.6. При взаимодействии арсенита натрия с
галогеноуксусными кислотами, при переходе от бромуксусной к иодуксусной
кислоте, несмотря на значительный рост энергии активации, наблюдается
существенное увеличение константы скорости реакции за счет повышения энтропии
активации.
Константы скорости реакции Мейера
увеличиваются в ряду CI < Br
< I. Это можно объяснить увеличением поляризуемости связи
углерод-галоген [4,5], что приводит к ослаблению связи C-HIg
и увеличению частичного положительного
заряда на α-углеродном атоме галогеноуксусной кислоты, по которому
происходит нуклеофильная атака арсенит-иона.
В отличие от реакции Мейера в случае
щелочного гидролиза галогеноуксусных кислот при переходе от бромуксусной к
иодуксусной кислоте энергия, энтропия активации и константы скорости гидролиза
уменьшаются. Таким образом, в реакциях Мейера и щелочного гидролиза
галогеноуксусных кислот скорость реакции определяется, главным образом,
изменением энтропии активации при переходе системы в активное состояние.
Константы скорости щелочного гидролиза
галогеноуксусных кислот изменяются в ряду
CI < Br < I.
Аналогичная антибатность в подвижности брома и иода отмечалась при изучении
щелочного гидролиза галогеноуксусных кислот [6], при взаимодействии аммиака с
галогеноуксусными кислотами в водном
растворе [6], бромистого и иодистого метила с метилатом натрия [7], водного
гидролиза галогеноуксусных кислот [8].
Это можно объяснить, исходя из кинетических
пространственных эффектов, изложенных в работе [9], с помощью которых К.
Ингольд дал объяснение, почему в некоторых случаях реакции замещения для
иодистых алкилов протекают медленнее по сравнению с бромистыми или имеют
сопоставимую скорость. При сближении несвязанных между собой атомов в начале
действуют слабые силы притяжения, а затем слабые силы отталкивания. Однако, при
определенном небольшом расстоянии силы отталкивания начинают быстро возрастать.
Атом иода имеет больший размер по сравнению с атомом брома и, поэтому,
увеличивается расстояние, при котором начинают возрастать силы отталкивания. В
некоторых случаях для образования переходного комплекса молекулы должны
настолько сблизиться, что силы отталкивания резко возрастают и становятся соизмеримыми
с энергией разрыва связи [9]. По-видимому, увеличением сил отталкивания между
валентно несвязанными атомами можно объяснить меньшие значения констант
скорости как щелочного, так и водного гидролиза [8] для иодуксусной кислоты по
сравнению с бромуксусной. В этом проявляются кинетические пространственные
эффекты, которые описывают как пространственные затруднения [9].
Значения констант скорости реакции Мейера k во всех случаях превосходят значения констант
скорости щелочного гидролиза kг соответствующих галогеноуксусных кислот. Это
позволяет сделать вывод, что арсенит-ион ![]() обладает более
высокой нуклеофильной реакционной способностью, чем гидроксид-ион. С
увеличением температуры отношение k/kг
уменьшается, что свидетельствует об увеличении вклада щелочного гидролиза в
общую скорость изучаемого процесса. Отношение величин k/kг возрастает в ряду Br<Cl<J. При использовании в реакции Мейера иодуксусной
кислоты можно достичь наибольшей скорости процесса и получить максимальный
выход натриевой соли карбоксиметиларсоновой кислоты (III).
обладает более
высокой нуклеофильной реакционной способностью, чем гидроксид-ион. С
увеличением температуры отношение k/kг
уменьшается, что свидетельствует об увеличении вклада щелочного гидролиза в
общую скорость изучаемого процесса. Отношение величин k/kг возрастает в ряду Br<Cl<J. При использовании в реакции Мейера иодуксусной
кислоты можно достичь наибольшей скорости процесса и получить максимальный
выход натриевой соли карбоксиметиларсоновой кислоты (III).
На скорость реакции Мейера и выход
алкиларсоновых кислот значительное влияние оказывает выбор среды. Обычно,
взаимодействие галоидпроизводных с арсенитами щелочных металлов осуществляется
в водно-щелочной или спирто-водно-щелочной средах [1]. Казалось интересным
определить влияние добавок протонных и апротонных растворителей на константу
скорости взаимодействия арсенита натрия с хлоруксусной кислотой. Так как,
реакция Мейера сопровождается параллельно протекающим щелочным гидролизом
хлоруксусной кислоты первоначально было изучено влияние добавок органического
растворителя на константу скорости взаимодействия хлоруксусной кислоты с
гидроксидом натрия kг.
Кинетические исследования щелочного
гидролиза хлоруксусной кислоты проводились с содержанием органического
растворителя в реакционной среде 20% об. при 25оC. В
качестве протонных растворителей использовался: метанол, этанол, 1-пропанол,
2-пропанол, 2-метилпропанол-2, а в качестве апротонных: тетрагидрофуран,
диметилсульфоксид, диметоксиметан, 1,4 - диоксан, ацетон. Константы скорости
щелочного гидролиза хлоруксусной кислоты приведены в табл. 3.
При добавлении в реакционную среду как
протонного, так и апротонного растворителей наблюдается незначительное
увеличение константы скорости щелочного гидролиза хлоруксусной кислоты.
Аналогичные изменения константы скорости щелочного гидролиза бром - и иодуксусных кислот в водно - этаноловом и
в водно- диоксановом растворах отмечены в работе [10].
Таблица
3
Константы скорости реакции хлоруксусной кислоты с гидроксидом
натрия в смешанных растворителях при 25![]()
с0Hlg : с0NaOH = 1 : 3.67
|
Растворитель
(20%) |
ε (25°C) [11] |
kг ∙ 106, л/(моль∙c) |
|
Вода
(100% об.) |
78.54 |
1.830
± 0.046 |
|
Протонные растворители |
||
|
Метанол Этанол 1
– пропанол 2
– пропанол 2
– метилпропанол-2 |
32.70 24.55 20.33 18.30 12.47 |
3.556
± 0.0686 2.072
± 0.0907 2.706
± 0.289 2.153
± 0.0307 2.871
± 0.179 |
|
Апротонные
растворители |
||
|
1,4
– диоксан Диметоксиметан Тетрагидрофуран Ацетон Диметилсульфоксид |
2.21 2.70 (20 °C) 7.39 20.54 48.9 (20 °C) |
2.483
± 0.120 2.778
± 0.102 2.896
± 0.180 2.035
± 0.0478 3.428
± 0.241 |
Для определения влияния смешанных растворителей на константу
скорости реакции Мейера была изучена кинетика реакции арсенита натрия с
хлоруксусной кислотой в водно-щелочной среде в присутствии 2-пропанола и
1,4-диоксана при 25![]() .
.
В табл. 4 приведены значения констант скорости реакции
арсенита натрия с хлоруксусной кислотой смешанных растворителях.
Таблица
4
Константы скорости
реакции арсенита натрия с хлоруксусной кислотой и щелочного гидролиза
хлоруксусной кислоты в смешанных
растворителях при 25![]()
с0I :
с0Hlg : с0NaOH = 1 :
(0.87 ÷ 2.63) : (5.11 ÷ 10.80)
|
|
k ∙ 106, л/(моль ∙ с) |
kг ∙ 106, л/(моль ∙ с) |
k/kг |
|
Вода (100%) |
24.59 ± 0.812 |
1.830 ± 0.046 |
13.0 |
|
2 – пропанол |
|||
|
10 20 30 40 |
30.23 ± 0.0502 35.91 ± 0.0887 44.03 ± 0.182 47.99 ± 0.267 |
2.050 ± 0.215 2.153 ± 0.0307 2.509 ± 0.185 2.683 ± 0.140 |
14.7 16.7 17.5 17.9 |
|
1,4 – диоксан |
|||
|
30 40 |
50.01 ± 0.0637 66.21 ± 0.157 |
2.617 ± 0.0488 3.608 ± 0.155 |
19.1 18.4 |
С
увеличением содержания органического растворителя в реакционной среде константа
скорости реакции Мейера k возрастает. Соотношение
констант скоростей реакции Мейера и щелочного гидролиза k/kг по сравнению с водной
фазой существенно не меняется. Влияние растворителей на скорость нуклеофильного
замещения описано К. Ингольдом в работе
[9]. По классификации К. Ингольда главными факторами, определяющими влияние
полярности растворителя на скорость реакции, являются тип заряда для
первоначального состояния реагента и субстрата и изменения зарядов при переходе
от исходного состояния к переходному. В изученных реакциях, щелочного гидролиза
и реакции Мейера, при добавлении к воде органического растворителя полярность
среды уменьшается. Как в случае щелочного гидролиза, так и в реакции Мейера в
элементарной стадии, определяющей скорость реакции, число зарядов остается
неизменным, в переходном состоянии происходит рассредоточение заряда и передача
отрицательного заряда к галогену.
В
случае щелочного гидролиза гидроксид-ион атакует частично положительно
заряженный α-углеродный атом хлоруксусной кислоты, при этом в переходном
состоянии происходит рассредоточение и передача отрицательного заряда от
гидроксид-иона к хлору.
![]()
![]()
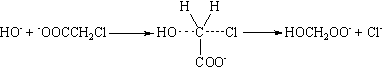
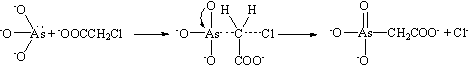
В
реакции Мейера арсенит-ион за счет неподеленной пары атома мышьяка атакует
частично положительно заряженный α-углеродный атом хлоруксусной кислоты,
при этом в переходном состоянии происходит рассредоточение заряда и передача
отрицательного заряда с одного из атомов кислорода арсенит-иона хлору.
![]()
![]()
Рассмотренный механизм, предполагающий
перераспределение отрицательного заряда от атома кислорода в анионе арсенита к
хлору объясняет необходимость проведения реакции Мейера в щелочной среде.
Как в случае щелочного гидролиза, так и в
реакции Мейера имеет место рассредоточение отрицательного заряда в переходном
состоянии и в соответствии с классификацией предложенной К. Ингольдом [9] с
уменьшением полярности растворителя должно наблюдаться увеличение константы
скорости реакции.
На скорость реакции Мейера оказывает также
влияние природа катиона арсенита щелочного металла [1]. В связи с этим казалось
интересным изучить влияние природы катиона гидроксида щелочного металла на
скорость реакции Мейера и щелочного гидролиза. Для этого исследована кинетика
щелочного гидролиза хлоруксусной кислоты с гидроксидами лития, натрия и калия
при 25![]() . Константы скорости щелочного гидролиза kг приведены в табл. 5.
. Константы скорости щелочного гидролиза kг приведены в табл. 5.
При замене катиона гидроксида щелочного металла
в ряду Li, Na, K
наблюдается незначительный рост значений констант скорости щелочного гидролиза
хлоруксусной кислоты.
Таблица 5
Константы скорости гидролиза хлоруксусной кислоты
гидроксидами лития, натрия и калия в водной среде при 25![]()
|
MeOH |
с0Hlg, моль/л |
с0NaOH, моль/л |
Продолжительность реакции, с∙102 |
Конверсия, % |
kг ∙106, л/(моль∙с) |
|
LiOH |
0.3290 0.3268 |
1.100 1.100 |
180 180 |
2.06 2.07 |
1.546
± 0.0710 1.524
± 0.0620 |
|
NaOH |
0.2998 0.3002 |
1.092 1.090 |
216 216 |
3.42 3.74 |
1.830
± 0.0462 1.826
± 0.0426 |
|
KOH |
0.2964 0.3169 |
1.100 1.100 |
216 216 |
3.85 3.87 |
2.291
± 0.157 2.335
± 0.0704 |
Примечание. а) Средние значения kг
∙106
для гидроксидов лития, натрия и
калия соответственно равны 1.535, 1.828, 2.313 л/(моль∙с).
Реакция
Мейера изучалась на примере взаимодействия хлоруксусной кислоты с арсенитами
лития, натрия и калия при 25![]() . Значения констант скорости реакции Мейера рассчитаны по
уравнению (1) и приведены в табл. 6.
. Значения констант скорости реакции Мейера рассчитаны по
уравнению (1) и приведены в табл. 6.
Так же, как и в случае щелочного гидролиза, в
реакции Мейера при замене катиона гидроксида щелочного металла от лития к калию
константа скорости реакции увеличивается.
Известно, что нуклеофил в составе ионной пары
обладает меньшей реакционной способностью по сравнению со свободным анионом
[12]. Чем меньше катион и анион тем более вероятно существование ионной пары.
Катион щелочного металла, имеющий меньший размер, обладает более плотной
сольватной оболочкой и в этом случае имеет место большее
электростатическое взаимодействие между
катионом и анионом, что приводит к более высокой вероятности существования ионных
пар. В ряду литий – натрий – калий с увеличением размера катиона гидроксида
щелочного металла увеличивается вероятность существования свободных гидроксид-
и арсенит-ионов, что приводит к увеличению значений констант скорости щелочного
гидролиза и реакции Мейера.
Таблица 6
Константы
скорости взаимодействия хлоруксусной кислоты с арсенитами лития, натрия и калия
в водно-щелочной среде при 25![]()
|
MeOH |
c0I, моль/л |
с0Hlg, моль/л |
с0NaOH, моль/л |
Продолжительность реакции, с∙102 |
Конверсия, % |
kг ∙106, л/(моль∙с) |
|
LiOH |
0.1999 0.2114 |
0.3497 0.3184 |
1.272 1.702 |
180 180 |
8.79 11.6 |
23.34±0.356 22.30±0.412 |
|
NaOH |
0.1921 0.1951 |
0.3020 0.2993 |
1.700 1.706 |
216 216 |
13.7 15.7 |
25.75±2.42 25.03±2.18 |
|
KOH |
0.2099 0.2270 |
0.2962 0.2270 |
1.708 1.700 |
144 216 |
16.8 23.4 |
39.77±2.36 40.77±2.59 |
Примечание. а) Средние значения kг ∙106 для
арсенитов лития, натрия и калия соответственно равны 22.82, 25.39,
40.27 л/(моль∙с).
Полученные кинетические и
термодинамические параметры свидетельствуют о протекании реакции Мейера по SN2 механизму, где в качестве нуклеофила выступает
арсенит-ион. Сравнение величин k и kг
позволяет
сделать вывод о том, что арсенит-ион As![]() обладает более
высокой нуклеофильной способностью, чем гидроксид-ион.
обладает более
высокой нуклеофильной способностью, чем гидроксид-ион.
Литература:
[1] Фрейдлина Р.Х.//
Синтетические методы в области металлоорганических соединений мышьяка. М.; Л.:
Изд. АН СССР, 1949. 180с.
[2] Serves
S.V., Sotiropoulos D.N., Ioannou P.V., Dixon H.B. // Phosph., Sulfur, Silico. 1994. Vol.
90. N 1-4. P. 103-109 // РЖХим.
1995. 16 Б 478.
[3] Эммануэль Н.М., Кнорре
Д.Г.// Курс химической кинетики. М.: ВШ, 1984. 463с.
[4] Справочник
химика / Под ред. Б. П. Никольского. Л.; М.; ГНТИ, 1963. Т. 2. С. 1024.
[5] Верещагин А.
Н. Поляризуемость молекул. М.: Наука,
1980. 176 с.
[6] Дариенко П.
И., Сапожникова Н. В. // Изв. ВУЗ
СССР. Химия и хим. технол. 1960. Т. 3. С. 461.
[7] Hine J, Thomas C. H., Ehrenson S. J. // J. Am. Chem.
Soc. 1955. Vol. 77. № 14. P. 3886.
[8] Рахматуллин
Р. Р., Селютина О. А., Гаврилов В. И.
// Вестник КГТУ. 2006. Вып. 6. С. 36.
[9] Ингольд К.К. // Механизм
реакций и строение органических соединений. М.: ИЛ., 1959. 673с.
[10] Дариенко Н.И., Сапожникова Н.В.// Изв. вузов
СССР. Хим. и хим. технол. 1966. Т.2.С.223.
[11] Ахадов Я.Ю.// Диэлектрические свойства
чистых жидкостей. М.: Изд. Стандартов, 1972. 411с.
[12] Днепровский А.С., Темникова Т.И.//
Теоретическое основы органической химии. Л.: Химия, 1979. 520с.