Химия и химические технологии
Кинетика и катализ
Рыльцова И.Г., Воронцова О.А., Нестройная О.В., Лебедева
О.Е.
Белгородский
государственный национальный
исследовательский университет, Россия
Слоистые двойные гидроксиды как
источники железа в окислительной системе Раффа
В настоящее время большое внимание уделяется поиску
эффективных и экологически безопасных способов инактивации органических
отходов. Одной из перспективных систем является так называемая система
Фентона/Раффа, которая представляет собой смесь солей железа (II)/(III)
с пероксидом водорода [1,2]. Значительный интерес вызывает поиск твердых
источников железа для данной каталитической системы, так как они могут легко
отделяться от продуктов окисления, способны к регенерации и повторному использованию.
Роль ионов железа заключается в генерации из пероксида водорода высокоактивных
радикальных частиц, выполняющих функцию окисления органических загрязнителей.
В настоящей работе проводилось изучение
каталитической активности системы Раффа, в которой в качестве источника железа
выступали слоистые гидроксиды (СДГ) со структурой гидроталькита. Гидроталькит
– это природный слоистый
гидроксокарбонат магния и алюминия - [Mg6Al2(OH)16CO3·4H2O]. Общая формула гидроталькитоподобных соединений –
[M2+1-хМ3+х(OH)2]х+[(An-)x/n·mH2O], где М2+ и М3+ – ионы
металлов, Аn- –анионы. Выбор данного
класса соединений обусловлен тем, что слоистые гидроксиды легко подвергаются
целенаправленному модифицированию, поскольку состав катионов в гидроксидных
слоях и анионов в межслоевом пространстве можно варьировать в широких пределах.
Две серии
железосодержащих слоистых гидроксидов были
синтезированы методом соосаждения компонентов из растворов солей
соответствующих металлов при рН = 9-10. При синтезе второй серии в раствор вводили
пероксид водорода (образцы с индексом «П»). Получены образцы, в структуре
которых ионы алюминия полностью заменены на ионы железа (Mg/Fe),
и образцы, где такое замещение составляет 20 атомных процентов (Mg/AlFe20).
В качестве субстрата для каталитического
окисления был выбран индигокармин, деструкция которого в гомогенной системе
Раффа изучена ранее [3]. Эксперимент по окислению проводили в водных растворах,
объемом 25 мл. Навеска катализатора составляла 0,1 г, исходная концентрация
индигокармина в растворе – 0,104 ммоль/л. За изменением его концентрации в ходе
эксперимента следили методом спектрофотометрии на
спектрофотометре UV/Vis
Specord 50. Полученные кинетические кривые приведены на
рисунке.
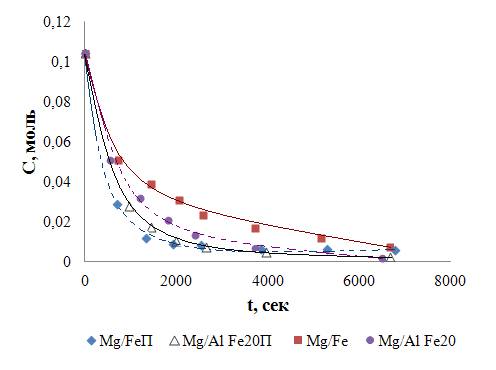
Рисунок. Кинетические кривые окисления индигокармина пероксидом
водорода в присутствии железосодержащих СДГ
Из приведенных данных следует, что все образцы Fe3+-СДГ проявляют высокую
активность в данном процессе. Однако на начальном этапе скорость окисления
индигокармина на Fe3+-СДГ, полученных в
присутствии пероксида водорода, несколько выше. Вероятно, это обусловлено тем,
что образцы, полученные в среде пероксида водорода, имеют более развитую (в 2-3
раза) поверхность по сравнению с аналогами, синтезированными без пероксида. Этот
же фактор может объяснить и меньшую активность образца Mg/Fe
по сравнению с Mg/AlFe20.
Слоистые двойные гидроксиды являются
сложными гидроксосолями, состоящими из заряженных бруситоподобных слоев и
анионов в межслоевом пространстве,
способных к ионному обмену. Исходя из того, что индигокармин в водном
растворе является анионом, можно предположить, что он не только подвергается
окислению, но и без разложения сорбируется на заряженной поверхности слоев и в
межслоевом пространстве. Однако наблюдения показали, что после окончания
эксперимента поверхность катализатора не изменяла окраски, что может быть
косвенным подтверждением полного окисления субстрата. Вероятнее всего, процесс окисления
двухстадийный: на первом этапе идет адсорбция индигокармина на поверхности катализатора,
на втором - собственно окисление.
Исследование выполнено в рамках госзадания по
НИР, регистрационный номер 38532011.
Литература:
1.
Соложенко Е.Г., Соболева
Н.М., Гончарук В.В. Применение каталитической системы H2O2 - Fe2+(Fe3+) при
очистке воды от органических соединений // Химия и технология воды. 2004. Т.26.
№ 3. С. 219-241.
2. Сычев А.Я., Исак В.Г. Соединения железа и механизмы гомогенного катализа
активации О2, Н2О2 и окисление органических субстратов // Успехи химии. 1995. Т. 64.
№ 12. С. 1183-1209.
3. Ерохин К.С., Жибурт В.С., Глухарева Н.А., Лебедева О.Е. Окислительная деструкция индигокармина // Научные ведомости Белгородского государственного университета. Серия Естественные науки. 2011. №9 (104). Вып.5. С. 57-61.