Распределение
температуры по радиусу обогреваемой трубы заполненной катализатором, на котором
происходит реакция с большим увеличением объёма реагирующего газа и сильным
стоком тепла.
(Конверсия природного
газа)
Игумнов В.С., Вавилов С.Н., Тепляков И.О., Лозина Е.Ю., Гусева
А.А., Кубриков К.Г., Разуванов Н.Г., Мамайкин Д.С..
Объединенный институт высоких температур РАН.
Проект № 13-08-00262
1. Введение
Экспериментально исследовались
реакции взаимодействия метана с водяным паром и двуокисью углерода по химическим формулам:
206кДж/моль + СН4 +
Н2О = 3 Н2 + СО
(1);
248кДж/моль + СН4 + СО2 = 2
Н2 +
2СО (2);
∆Н
+ СН4
+ n Н2О + (1-n) СО2 = (2+n) Н2 + (2-n) СО (3),
где (3) паро-углекислотная конверсия метана , 0<n<1 – стехиометрический коэффициент
и 206кДж/моль < ∆Н
< 248кДж/моль, для n=0 ∆Н= 248кДж/моль, если n=1, то ∆Н= 206кДж/моль. Из этих реакций видно, что из двух молекул образуется 4 молекулы.
Поскольку реакция происходит в газовой фазе, наблюдается эффект увеличения скорости
течения реагирующих газов пропорционально скорости реакции. Второй эффект –
реакции сильно эндотермичные. Для
сравнения – кипение воды при давлении 1
бар и 273К поглощает 41 кДж/моль. Нужное количество тепла в зону реакции
согласно физическому смыслу процесса переноса тепла от стенки к катализатору подвести
не возможно, поэтому проходит менее энергоёмкая реакция:
СН4 + 78
кДж/моль = С + 2 Н2 (4),
В катализаторе отлагается
углерод.
В промышленности
такая ситуация не приемлема, т.к. отложения углерода разрушают катализатор и приводят
к аварийной ситуации в обогреваемой трубе. Для формального снижения теплового
эффекта используется увеличение окислителей Н2О и СО2 над стехиометрией в более
чем в 3 раза. В [1 и 2] используется термин – скрытая эффективная теплота
реакции Qэф и вычисляется по формуле:
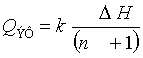
![]()
![]()
Где ∆Н – стандартный
тепловой эффект, а n – избыток Н2О и СО2 над
стехиометрией в химических реакциях выглядит так:
СН4 + Н2О +
nН2О =
СО + 3 Н2 + nН2О (5)
СН4 + СО2 +
nСО2 = 2 СО + 2 Н2 + nСО2 (6).
Для примера: если n=3, то Qэф= 51,5 кДж/моль для паровой конверсии и 62 кДж/моль
для углекислотной, т.е. возможен реальный подвод тепла в слой
каталитической насадки для осуществления полных химических реакций (1), (2) и
(3). Для исследования структуры потоков в реагирующем газе проведены измерения
температуры в слое катализатора и концентрации метана по радиусу обогреваемой
трубы. Коэффициент пропорциональности k=1, если в
на входе в слой катализатора отсутствуют газы не участвующие в исходной реакции на практике это Н2
, СО и N2 . Следует подчеркнуть: 1. термодинамически вероятен целый ряд реакций, но
для определения физического смысла рассматриваемого процесса используем реакции
(1 – 6) [3]. 2. молекулярный механизм в порах катализатора включает
промежуточную твёрдую фазу углерода, но это не нарушает в макро предположения о
том, что реакция протекает в газовой фазе в контексте представленной
публикации.
2. Эксперимент
Реакция происходит на
никелевом катализаторе ГИАП-16 (аналог C-II-2S, CCI, made in USA) [3]. Этот катализатор выбран как наиболее исследованный
объект катализа конверсии метана с хорошо известными и определенными экспериментально
свойствами. На рис.1 изображена труба заполненная катализатором и обогреваемая
прямым пропусканием электротока. Труба (реактор) имеет длину 1,5м, диаметр
0,054м, толщину стенки 0,003м. Расход метана на входе в трубу 0,25*10(-3)нм3/с,
среднее давление 60*10(3)кПа. На одну молекулу метана приходится 4 молекулы
воды. Измерения температуры реагирующих газов, стенки и концентраций,
проводилась на 11 измерительных сечениях. Подробный эскизный чертёж измерительного
сечения представлен в работе [4]. Температура стенки измерялась также между
сечениями. Средний тепловой поток составлял 11кВт/м2. На Рис.2 показано
распределение температуры по радиусу трубы в сечении трубы в сечении
обозначенного на Рис.1 линией Lr. Рис.2 иллюстрирует характер функции распределения температуры по
радиусу во всех измерительных сечениях когда соотношение Н2О/СН4>1,5 (на
рис.1 Н2О/СН4=4).
Для
проведения конверсии метан в стехиометрическом отношении использован метод
предварительного нагрева смеси метана и окислителей (Н2О и СО2) на ингибиторе ZrО2. Описание физического смысла этой технологии в работах
[1,2].
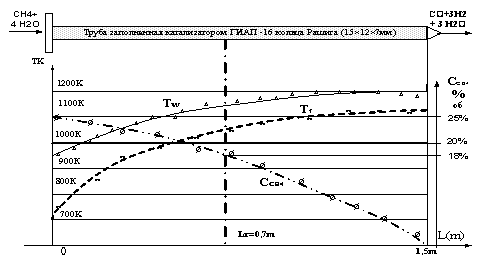
Рис.1 Экспериментальная
обогреваемая труба заполненная катализатором эксперимент: ø – концентрация метана Ссн4, ∆
- температура стенки Тw, х – температура реагирующего
газа Тf. Сплошная и пунктирные линии – аппроксимация.
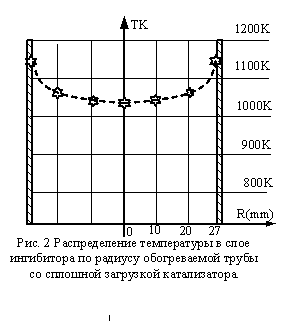
На
Рис.3 представлен эксперимент, где смесь метана и водяного пара на входе в
трубу нагревается без реакции на ингибиторе – шарах из ZrО2. На ZrО2 СН4 не реагирует с Н2О, а
нагревается до температуры близкой температуре стенки. Реакционная смесь, поступая
в слой катализатора, бурно реагирует в зоне наиболее активной реакции (ЗНАР-1).
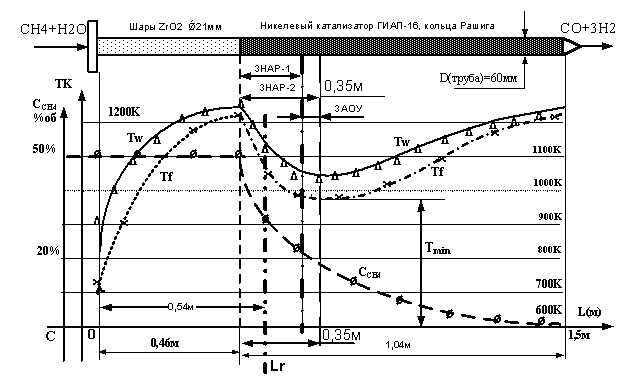
Рис.3. Экспериментальная
обогреваемая труба заполненная ингибитором ZrО2 и катализатором эксперимент: ø – концентрация метана Ссн4, ∆ - температура стенки Тw, х – температура реагирующего газа Тf. Сплошная и
пунктирные линии – аппроксимация. Зона ЗНАР-1 это зона наиболее активной
реакции. Зона ЗНАР-2, зона наиболее активной реакции в условиях инициации
отложений углерода и зона ЗАОУ – зона наиболее активного отложения углерода в
условиях инициации.
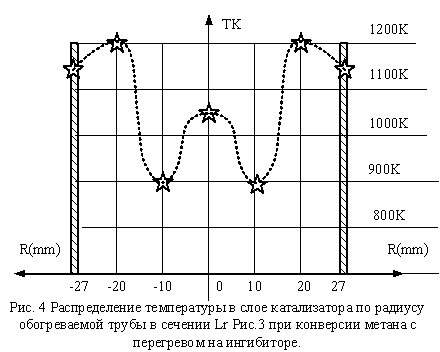
На рис. 3 ЗНАР делится на две
зоны ЗНАР-1 и ЗНАР-2. ЗНАР-2 определена для условий, когда инициируется
выделение углерода, т.е. Н2О/СН4<1. Для нормального случая ,когда Н2О/СН4=1
имеет место участок ЗНАР. Здесь тепловой поток составляет 23 кВт/м2. Измерение
распределения температуры по радиусу на участке ЗНАР показано на Рис.4. Это пример для сечения Lr . Видно, что в отличие от условий, когда Н2О/СН4>1,5 температура в слое
катализатора развивается не монотонно и имеет экстремумы.
Обсуждение экспериментов.
Во входящей и нагретой на
ингибиторе смеси газов в катализатор на участке ЗНАР-1 реагирует 40% метана.
Получается, что на выходе из ЗНАР-1 эффективная скрытая теплота реакции
составляет 57 кДж/моль (k ≠ 1), т.е. приемлемые
условия для подачи тепла на конверсию, поэтому углерод не выделяется. В слое
каталитической насадки ЗНАР, где происходит химическая реакция, имеет место большой
температурный напор.
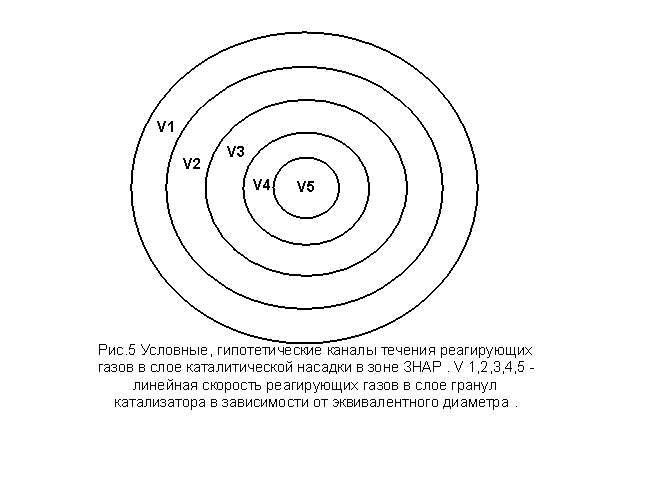
На участке ЗНАР-1 происходит
активная химическая реакция образования. Формальная общая скорость химической
реакции – Ω, является функцией температуры. Изменение температуры на ±10К
и более в настоящих условиях приводит к изменению Ω на 10-30% и соответственно меняются скорости течения газа.
Такое явление по сечению температуры газа приводит значительной деструкции
газового потока по сечению слоя насадки. Скорость газового потока может
изменять направление в противоположном направлении вектору суммарного течения.
Для математического описания абриса функции скорости течения газа необходимо
разбить сечения реактора на концентричные окружности. Число окружностей равно частному
от деления диаметра реактора на эквивалентный диаметр слоя насадки DЕК определяемому по формуле:
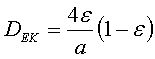 ,
,
![]()
![]() где ε –
порозность слоя насадки, а (м2/м3) – удельная поверхность
всего слоя насадки (м ). Условие для
общей скорости по сечению должно соответствовать следующему выражению:
где ε –
порозность слоя насадки, а (м2/м3) – удельная поверхность
всего слоя насадки (м ). Условие для
общей скорости по сечению должно соответствовать следующему выражению:
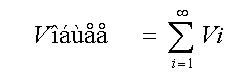
Для расчета Ω можно воспользоваться данными из [5].
Работа выполнена
согласно инициативному проекту РФФИ № 13-08-00262
Литература:
- Igumnov V.S. “Technical and technological methods of realization of steam catalytic conversion of natural gas with a methane-water proportion close
to stoichiomythic ratio” , Hydrogen materials science and chemistry of
carbon nanomaterial, NATO security science setias – A: Chemistry and
Biology, The NATO Programmer for
Security through science. Page
555-561. 2007.
- Игумнов В.С., Визель Я.М. Каталитическая конверсия углеводородов в
обогреваемой трубе при отношении пар/газ близком к стехиометрическому; Катализ в промышленности. М., 2010,
№6, с 34-41
- Справочник азотчика: Физико-химические свойства газов и жидкостей.
Производство технологических газов. Очистка технологических газов. Синтез аммиака. М.: Химия, 1986.
- Игумнов В.С., Вавилов С.Н., Тепляков И.О., Гусева А.А., Лозина Е.Ю.,
Кубриков К.Г., Мамайкин Д.С., Виноградов Д.А. «Испытания эффективности загрузки и формы
катализатора и ингибирующей насадки конверсии природного газа в
обогреваемой трубе. Интегральные эксперименты», (сборник докладов стр.61-70)
Materialy VIII mezinarodni vedecko-practica conference, “APLIKOVANE VEDECKE NOVINKY – 2012”, 27 červenců - 05 srpna 2012
roku, Díl 10 Lékařství Biologické
vědy Chemie a chemická technologie, Praha, Publishing House «Education and
Science» s.r.o, 2012, Vydáno Publishing House «Education and Science»,
Frýdlanská 15/1314, Praha 8, Spolu s DSP SHID, Berdianskaja 61 Б, Dnepropetrovsk, VIII sběrné nádobě obsahují
materiály mezinárodní vědecko - praktická
konference «Aplikované vědecké novinky» (27 červenců - 05 srpna 2012
roku) po sekcích
«Lékařství». «Biologické
vědy».
«Chemie a chemická
technologie» Pro studentů, aspirantů
a vědeckých pracovníků,
Cena 270 Kč. ISBN 978-966-8736-05-6
- Игумнов В.С. , Тепляков И.О. «Конверсия
углеводородов для утилизации попутных газов на удалённых нефтяных
промыслах в экологически чистые дизельное топливо и бензин». «Экология и промышленность России» (ЭКиП),
№3, 2012.