Д.ф.-м.н.
Тен Г.Н.*, аспирантка Яковлева А.А.*, д.ф.-м.н. Баранов В.И.**
* Саратовский государственный университет им. Н.Г.
Чернышевского
** Институт
геохимии и аналитической химии им. В.И. Вернадского РАН, Москва
ВЛИЯНИЕ
ВОДОРОДНОЙ СВЯЗИ НА КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ ЦИКЛИЧЕСКИХ ДИМЕРОВ УРАЦИЛА
Введение. Экспериментальное и теоретическое исследование
колебательных спектров урацила и его замещённых являлось предметом многих
исследований [например, 1-7]. Особое внимание было уделено определению влияния
водородных связей на ИК спектры [8-10]. В первую очередь это связано с тем, что
взаимодействие оснований нуклеиновых кислот посредством водородных связей
является фундаментальным в биологических соединениях. Определение физических и
химических критериев образования водородных связей, в том числе
спектроскопических, позволяет не только глубже понять специфичность
взаимодействия оснований нуклеиновых кислот в комплементарных парах, но и
проследить за теми структурными изменениями оснований нуклеиновых кислот,
которые происходят, например, при таутомерии, в различных фазовых состояниях.
Одними из наиболее распространённых молекулярных систем, полученных с помощью
водородных связей, являются димеры. Это и димеры комплементарных пар
(аденин-тимин, гуанин-цитозин, аденин-урацил), и димеры, образованные в
результате гомоассоциации нуклеиновых кислот в разных фазовых состояниях.
Известно, что в неполярных растворителях
основания нуклеиновых кислот образуют димеры [11-13]. В воде, где очень велик
эффект гидратации, гомоассоциаты урацила образуют главным образом вертикальные
«стопки» [14,15]. Кроме того, в воде основания нуклеиновых кислот могут
формироваться в виде циклических и открытых димеров, как это показано методом
ЯМР [16-18]. В кристаллической структуре урацила можно выделить димеры,
которые, как подтверждает рентгеноструктурный анализ, являются центросимметричными
[19-21].
Влияние водородных связей на колебательный
спектр урацила обычно изучается посредством экспериментального измерения ИК и
КР спектров в разных условиях – изолирующих матрицах [4-7], твёрдом и жидком
фазовых состояниях [1-3], которые сопровождаются проведением расчётов в
различных приближениях. Но можно изучать влияние водородных связей и
непосредственно по спектрам изолированных димеров урацила, экспериментальные ИК
и КР спектры которых были получены в Ar и N2 матрицах
[15], а FT-IR спектры
димеров урацила и тимина – в N2 матрице при различных концентрациях [22].
Ранее неэмпирический расчёт структуры
циклических димеров урацила, а также исследование влияния водородной связи
открытых и циклических димеров урацила на их колебательные спектры был выполнен
в приближении B3LYP/6-311+G(d,р) авторами работы [22]. Сравнение с
экспериментальными спектрами позволило объяснить появление широких диффузных
полос поглощения в области ~850, ~1430 и ~1500 см-1 за счёт образования водородных связей в димерах
урацила. В то же время не была проведена полная интерпретация колебательных
спектров димеров, что важно для
определения влияния водородных связей, например, на колебательный спектр
поликристаллического урацила. Проанализированные смещения частот и
интенсивностей колебательных полос поглощения димеров относились только к валентным
и деформационным колебаниям NH, CH и CO связей. Не
был выполнен сравнительный анализ спектров центросимметричных и несимметричных
димеров урацила. Кроме того, представляет интерес определить влияние водородных
связей на спектры КР димеров, который также не был рассмотрен ранее [22].
Цель данной работы - провести теоретическое исследование влияния
водородной связи на колебательные спектры (ИК и КР) циклических димеров урацила
методом B3LYP/6-311++G(d,р) и сравнить
колебательные спектров центросимметричных и несимметричных димеров со спектрами
изолированного урацила.
Результаты
и обсуждение. Расчёты были проведены для шести циклических димеров
урацила, три из которых являются центросимметричными (UU1, UU2, UU3), а три другие (UU4, UU5, UU6) не обладают центром симметрии (рис. 1).
Молекулярная диаграмма урацила (Ura) с
обозначением атомов дана на рис. 2.
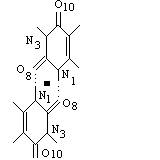
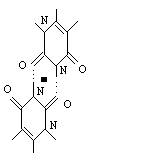
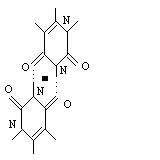
UU1 UU2 UU3
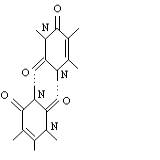
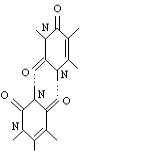
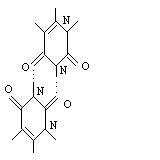
UU4
UU5
UU6
Рис. 1. Молекулярные диаграммы димеров урацила.
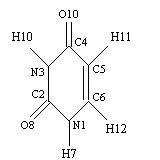
Рис. 2. Молекулярная диаграмма урацила с
обозначением атомов
Влияние водородной связи на смещения
частот нормальных колебаний димеров по сравнению с урацилом. Димеры урацила имеют 66 нормальных колебаний. Из них
для центросимметричных димеров 33 колебания активны в ИК спектрах и 33 – в
спектрах КР. Спектры
нецентросимметричных имеют несравненно более сложную колебательную структуру,
т.к. и в ИК, и в КР спектрах
проявляются все 66 колебаний. Значения вычисленных частот, интенсивностей полос
поглощения и линий комбинационного рассеяния, а также форм колебаний для
центросимметричных колебаний приведены в табл. 1, а для нецентросимметричных –
в табл. 2. Для анализа и определения характерных изменений, происходящих при
образовании димеров, был выполнен расчёт колебательных спектров изолированного
урацила (табл. 3).
Максимальное расщепление частот колебаний,
вырожденных для центросимметричных димеров и невырожденных – для
нецентросимметричных, наблюдается для неплоских колебаний связей NH, участвующих в образовании водородных связей в
спектральных областях ~570-680 см-1 и ~840¸940 см-1. Для центросимметричных димеров UU1, UU2 и UU3 расщепление частот вырожденных колебаний r(N1H) и r(N3H) составляет 46, 27 и 31 см-1,
соответственно. Величина частотного расщепления аналогичных колебаний димеров UU4 и UU5 в два раза
больше и составляет 94 и 87 см-1. Расчёт показывает значительное (~40 см-1) расщепление линий поглощения в
димерах UU5 и UU6, соответствующих
колебаниям связей С=О и СN, также
участвующих в образовании водородной связи. Величина расщепления частот
остальных колебаний не более 10 см-1.
Изменения частот колебаний Ura, которые имеют место при образовании димеров, также
носят ярко выраженный и систематически повторяющийся характер. Практически во
всей спектральной области наблюдается повышение частот колебаний димеров по
сравнению с колебаниями Ura: для
неплоских и деформационных колебаний разность частот D составляет ~20 см-1, а для валентных колебаний она
снижается до ~5¸10 см-1.
Значительные изменения (от ~50¸ 350 см-1)
частот наблюдаются для тех колебаний, форма которых определяется изменениями
связей, принимающих непосредственное участие в образовании водородных связей.
Вопрос влияния кислотных и основных свойств атомов азота и кислорода на
величину смещения частот при образовании димеров урацила обсуждался в работе
[22].
Интерпретация колебательных спектров
димеров. Образование
димеров приводит к возникновению шести дополнительных колебаний,
характеризующих смещения двух молекул Ura как
целых молекулярных образований друг относительно друга вдоль водородных связей.
Колебания №1, 2 и 3 представляют соответственно веерные и крутильные (синфазные
и противофазные) колебания без изменения длины водородной связи. При совершении
колебания №5 происходит изменение валентного угла, образованного водородной
связью, но без изменения длины водородной связи. Наибольший интерес
представляют колебания №4 и 6, при
которых происходят изменения длин водородных связей, причём при колебании №4
увеличение одной длины водородной связи сопровождается уменьшением другой, а
при колебании №6 наблюдается одновременное увеличение или уменьшение обоих длин
водородных связей. Необходимо отметить, что характер колебаний № 1-6 не зависит от
симметрии димеров и, соответственно, от типа водородных связей.
В спектральной области ~150¸1000 см-1 колебания (№ 7-38) всех димеров и Ura имеют одинаковые
формы и ~ равные значения частот, за исключением колебаний
(№ 21-22, 31-32) выхода связей NН из плоскости. Для Ura частота колебания r(N1H) равна 554 см-1, а частота колебания r(N3H) – 672 см-1. Образование водородных связей приводит к
повышению частот этих колебаний в димерах, причём величина смещения в
центросимметричных димерах зависит не от атома азота, а от атома кислорода, с
которым образуется водородная связь: для UU1 и UU2 частоты колебаний r(N1H), r(N3H) смещаются в область 850-890
см-1, а для UU3 – в область
910-940
см-1. Для всех трёх нецентросимметричных димеров колебания в области
~850 см-1 является
антисимметричными, а колебания с частотами вблизи ~905 см-1 – симметричными колебаниями выхода связей N1H и N3H из плоскости и
величина их смещения не зависит от типа образуемых димерами водородных связей.
Интенсивности полос поглощения, отвечающие антисимметричным колебаниям в
несколько раз слабее симметричных, а для димера UU6 интенсивность, отвечающая
полосе поглощения колебания № 31, становится очень слабой и оба колебания
неактивны в спектре КР.
Также как и для Ura, колебаниям выхода связей СН из плоскости в
димерах соответствуют две области, которые для всех одинаковы – это области
вблизи ~815 и ~970 см-1. Но если для Ura колебание с частотой 812 см-1
является антисимметричным, а колебание с частотой 971 см-1 – симметричным
неплоским колебанием выхода связей С5H и С6H из плоскости
пиримидинового кольца, то в димерах форма этих колебаний гораздо сложнее. Для
них каждая область содержат как антисимметричные, так и симметричные колебания r(С5H), r(С6H). Так, при колебаниях
№ 29, 30 происходит антисимметричное и симметричное колебание симметричных
колебаний связей одного кольца в димере относительно таких же симметричных
колебаний обеих связей в другом кольце димера. Для колебаний № 31, 32
антисимметричное и симметричное колебание сопровождается антисимметричными и
симметричными колебаниями связей в каждом из пиримидиновых колец димеров.
«Дыхательное» колебание пиримидинового кольца является характеристическим,
хотя немного (на ~10 см-1)
повышается в димерах по сравнению с Ura и проявляется в области ~778 см-1. Интенсивность полосы поглощения этого колебания
является слабой, а в спектре КР – это одна из самых сильных по интенсивности линий.
Надо отметить, что в целом интенсивности полос поглощения колебаний
димеров могут в несколько раз превышать интенсивности полос поглощения
соответствующих колебаний Ura.
В области ~1000¸1550 см-1 для некоторых колебаний имеет место
смешение форм изменений длин связей и внешних деформационных углов. В случае
центросимметричных димеров смешение с деформационными колебаниями связей СН
наблюдается для колебаний № 39-44, а для нецентросимметричных – для колебаний №
39-46. Увеличение интенсивности полос поглощения для колебаний № 43-44 для UU1 и колебаний № 41-42 для UU2, UU3 по сравнению
с Ura связано с тем, что в этих колебаниях происходит
изменение длин связей пиримидинового кольца, участвующих в образовании
водородных связей, т.е. N1C2 и C2N3, соответственно.
Для изолированной молекулы урацила
смешение изменений длин связей с деформационными колебаниями b(N1H) наблюдается для колебаний с частотами 1405 и 1499 см-1,
а с деформационными колебаниями b(N3H) – для колебаний с частотами 1381 и 1420 см-1.
Образование водородных связей в димерах приводит, как и в случае неплоских
колебаний r(N1H), к повышению частоты
деформационных колебаний b(NH). Для димера UU1 с двумя одинаковыми водородными связями типа O8…Н7N1 частота деформационного колебания b(N1H) повышается до 1554 см-1, а
частоты колебаний b(N1H) практически не меняют своего значения по сравнению с
Ura. В случае двух других центросимметричных димеров UU2 и UU3,
образованных с помощью водородных связей O8…Н9N3 и O10…Н9N3, напротив, повышаются частоты деформационных колебаний b(N3H) в область ~1460-1480 см-1, а деформационное колебание
b(N1H) имеет частоту
в области 1420-1430 см-1, совпадающую
с частотой аналогичного колебания в Ura.
Для нецентросимметричных димеров смещения
деформационных колебаний b(NH) имеют аналогичный, но более
сложный характер. Например, анализ форм колебаний показывает, что в димере UU4, образованного двумя разными водородными связями O8…Н7N1 и O8…Н9N3, имеется несколько деформационных колебаний b(N1H) и b(N3H). Во-первых, это колебания с частотами 1393 и 1421
см-1, совпадающие с частотами аналогичных колебаний в Ura. Во-вторых, это
деформационное колебание b(N3H) с частотой 1475 см-1 и колебания b(N1H) с частотами 1493 и 1550 см-1, смещение
которых в высокочастотную область обусловлено водородными связями.
Таким образом, в спектрах димеров наряду с
частотами деформационных колебаний связей N1H и N3H в области
1380, 1405, 1420 и 1499 см, появляются полосы поглощения средней интенсивности
в области 1520-1550 см-1 за счёт смещения колебаний b(N1H), которое наблюдается только для димеров UU1, UU4 и UU5. Появление
другой полосы поглощения средней интенсивности в области 1470-1490 см-1 связано
со смещением частоты другого деформационного колебания b(N3H) в димерах UU2, UU3, UU4, UU5 и UU6. Кроме
этого, изменение форм колебаний в димерах в области 1200-1550 см-1
приводит к значительному изменению интенсивностей полос поглощения по сравнению
с Ura, например, в димере UU1 интенсивность полос поглощения колебаний с частотами
в области 1250 и 1440 см-1 становится очень сильной.
Частоты валентных колебаний связей С=О, в
отличие от деформационных колебаний, понижают частоту при их участии в
образовании водородной связи.
В
высокочастотной области ~3200¸3700 см-1 колебания
q(C5Н) и q(C6Н) для UU3 выше аналогичных колебаний для UU1 и UU2 на ~25¸30 см-1. Для колебаний q(N1Н) и q(N3Н),
участвующих в образовании водородной связи, наблюдается снятие вырождения
колебаний и величина расщепления составляет 44, 27 и 39 см-1 UU1, UU2 и UU3, соответственно.
Спектры КР димеров практически не меняются
по сравнению со спектрами КР изолированной молекулы Ura, поскольку все линии неплоских колебаний выхода связи
из плоскости r(NH) имеют слабую или
очень слабую интенсивность. Однако появление в спектрах КР сильной по интенсивности линии в области 1520-1550 см-1 позволяет
однозначно определить существование димеров урацила.
Выводы. Проведены расчёты колебательных спектров урацила и его шести димеров.
Рассмотрено влияние водородной связи на структуру и колебательные спектры.
Дана полная интерпретация колебательных спектров центросимметричных UU1, UU2, UU3 и нецентросимметричных
димеров UU4, UU5, UU6 и определены характерные спектральные проявления водородных связей O8…Н7N1, O8…Н7N1, O8…Н9N3, O10…Н7N1и O10…Н9N3 в ИК и КР спектрах. Показано, что в низкочастотной
области интерпретация колебательных полос, за исключением неплоских колебаний
связей NH, совпадает для всех шести димеров. В области ~1380¸1550 см-1 из-за
смешения форм изменения длин связей с деформационными колебаниями происходит смещение колебаний b(NH) в высокочастотную область и перераспределение интенсивностей,
что позволяет объяснить проявление «дополнительных» линий в колебательных
спектрах димеров.
Список литературы
1.
Susi H., Ard J.S. // Spectrochim.
Acta. – 1974. - 30A.- P. 1843-1853.
2.
Florian J., Hrouda V// Spectrohim.
Acta. -1993. - 49A. - P.921-938.
3.
Lord R.C., Thomas G.J. // Spectrochim. Acta.
- 1967. - 23A. - P. 2551-2591.
4. Szczesniak M., Novak M.J., Rostkowska H., Szczepaniak
K., Person W.B., Shigar D. // J. Am. Chem. Soc. - 1983. - 105. - P. 5969-5976.
5.
Barnes A.J., Stuckey M.A., Le
Gall L. // Spectrohim. Acta. - 1984. - 40A, №5. - P.419-431.
6.
Szczesniak M., Nowak M.J., Szczepaniak K., Person W.B. // Spectrochim.
Acta. - 1985. - 41A, №1.2. - P.237-250.
7. V. Barone, G. Festa, A. Grandi, N. Rega, N. Sanna. Chem. Phys. Lett., 2004.
– 388. - P. 279-283
8. Aamouche A., Ghomi M., Coulombeau C. et al. // J.Phys. Chem. - 1996. - 100,
13. - P.5224-5234.
9. Радченко Е.Д., Плохотниченко А.М., Шеина Г.Г., Благой
Ю.П.
// Биофизика. - 1983. - 28. - C.
923-927.
10. Г.Н.Тен, Т.Г.Бурова, В.И.Баранов. // ЖСХ. - 2001.- 42.
№4. - С. 666-676.
11. Жижина Г.П.,
Олейник Э.Ф. // Успехи химии. – 1972.
– 41. – С. 474 – 511.
12. Кочетков
Н.К., Будовский Э.И., Свердлов Е.Д., Симукова Н.А., Турчинский М.Ф., Шибаев
В.Н. Органическая химия нуклеиновых
кислот. – М.: Химия, 1970.
13. Зенгер В.
Принципы структурной организации нуклеиновых кислот. – М.: Мир, 1987.
14.
S.I.Chan, M.P.Schweizer, P.O.P.Ts’o, G.K.Helmkamp. // J. Am. Chem. Soc. 1964. – 86. – P.4182-4188.
15.
M.P.Schweizer,
S.I.Chan, P.O.P.Ts’o. // J. Am. Chem. Soc. – 1965. – 87. - 5241-5247.
16.
P.O.P.Ts’o,
I.S.Melvin, A.C.Olson. // J. Am. Chem. Soc. – 1963. – 85. - P. 1289-1296.
17.
P.O.P.
Ts’o, S.I.Chan. // J. Am. Chem. Soc. – 1964. – 86. – P. 4176-4181
18.
H.
Tuppy, E. Küchler. // Monatshefte für chemie. - 1964. B.- 95. - S.1677-1690.
19. G.A.Jeffrey, W.Saenger. Hydrogen Bonding in Biological
Structures. Berlin, Germany: Springer, 1991. 569 p.
20. Shimanouchi T., Harada I. // J. Chem. Phys. – 1964. –
41. – P. 2651 – 2655.
21.
G. Portalone, L. Bencivenni, M. Colapietro, A. Pieretti, F. Ramondo. //
Acta Chemica Scandinavica. - 1999. –
53. - P. 57-68.
22.
L. Bencivenni, F. Ramondo, A. Pieretti, N. Sanna. // J. Chem. Soc.,
Perkin Trans. - 2000. – 2. - P. 1685-1693.
23. G. Ferenczy, L. Haesanyi, B. Rozsondai, I.
Hargittai. J. Mol. Struct. 1986.- 140. – P. 71-77.