К.б.н. Лахтин М.В., д.б.н.
Лахтин В.М.,
д.м.н. Афанасьев М.С.,
д.м.н. проф. Афанасьев С.С.
Московский
научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н.
Габричевского, Россия
ТВЕРДОФАЗНЫЙ АНАЛИЗ
ФЛЮОРОФОРОВ И ФЛЮОРОФОРСВЯЗЫВАЮЩИХ КОМПОНЕНТОВ КУЛЬТУРАЛЬНОЙ ЖИДКОСТИ
ГРАМПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ
Введение. Культуральные жидкости (КЖ) – источники флюорогенных биологически активных низкомолекулярных веществ
(аминокислот, [глико]пептидов, других; способных к регистрируемому возбуждению флюоресценции,
характеризующей продукты в КЖ и облегчающей мониторинг их образования и
расходования) и высокомолекулярных веществ (белков, белок-содержащих, других; с
в различной степени маскированными флюорофорами и/или взаимодействующих с
флюоресцентными красителями). Такие флюорофоры-содержащие молекулы (ФСМ) и Ф-связывающие
комплексы (ФСК) участвуют в сигнальных, синергистических/согласованных
(в том числе каскадных) процессах нано/микро- и макросистемного био-узнавания/(селективного
распознавания), выполняют жизненно важные макрофункции в окружении и на
поверхности бактерий (смотри также другую нашу статью в настоящем сборнике).
Цель - с помощью твердофазного анализа (ТФА) исследовать
типы ФСМ и ФСК КЖ грамположительных бактерий на примере пробиотических штаммов
бифидобактерий и лактобацилл человека, мультиштаммового консорциума.
Материалы и методы. Препаратами служили разбавления в 10 мМ
фосфатно-солевом буфере 7.4 (ФСБ) обезжиренных и деэмульсифицированных КЖ (супернатантов),
высокомолекулярные концентраты (более
27 кД) КЖ лактобацилл Lactobacillus helveticus (штаммы NK1
и 100аш), L. casei K3III24, пробиотика Ацилакт (NK1+100аш
+K3III24), бифидобактерий Bifidobacterium longum MC-42
- все выращены на среде КД-5с (18-24 ч при 37оС). Белок определяли в
области поглощения пептидных связей по Waddel, 1956: [мкг/мл]= (D215
- D225)x144,
где 144- коэффициент, рассчитанный для БСА (бычьего сывороточного альбумина –
негликозилированного, с высокой гидрофобностью). Для повышения сорбции материала
в дотах и увеличения числа экспонированных флюорофоров блоты обрабатывали 5 мМ
дитиотреитолом в ФСБ (80оС, 7 мин). Для исключения влияния на ТФА
гидролаз образцы КЖ кипятили 30 мин. КЖ содержали до 1 мкг/мкл гидрофобного
белка. Образцы (по 3 мкл сериальных разбавлений КЖ, исходно сконцентрированных
в 60-100 раз КЖ или БСА [исходно 2 мг/мл в ФСБ] в 10, 100, 1000, 10000 и 100000
раз; стоковые разведения готовили заранее и хранили в эппендорфах при -35оС)
наносили рядами дотов на гидрофобную PVDF-мембрану
Immobillon-P
(Millipore). Флюоресценцию компонентов (собственную или
после обработки красителем SYPRO Ruby protein blot stain [далее - SYPRO] - сравнимым с коллоидным золотом по чувствительности; на основе
рутения [Ru]; не реагирует с нуклеиновыми кислотами, имеет пики
возбуждения 280 и 450 нм и пик испускания флюоресценции около 618 нм) определяли
на сухих блотах в режиме живого изображения в системе BioChemi System (UVP;
возбуждение 254 нм [возбуждение Phe, Tyr
и Trp, их производных, SYPRO)
или 365 нм (возбуждение SYPRO)
и регистрации серий картин свечения с
использованием светофильтра Coomassie (возбуждение 254 нм
позволяет оценивать также выраженность белка [его вклад в флюоресценцию] в
разведениях супернатанта или его концентрата до обработки блота посредством SYPRO) или светофильтра Ethidium Bromide (570-640 нм: оранжевый свет); интервал ступеней времени
накопления флюоресценции 270 - 60000 миллисекунд (получение взаимодополняющей информации,
в зависимости от оптимизации выполнения типа задачи). Для количественного
сравнения флюоресценции области дотов сканировали. В анализе использовали пакет
программ LabWorks.
Результаты и их обсуждение.
1. ФСМ с собственной флюоресценцией. ТФА выявил наличие регистрируемой нестабильной флюоресценции
(появляющейся при разбавлениях как в случае БСА или способной нарушать дозовую
зависимость в разбавлениях как в случае концентратов супернатантов КЖ; не
нарушалась дозовая зависимость в случае супернатантов КЖ) в составе сорбированных
препаратов (высокомолекулярных
концентратов, исходных супернатантов КЖ; БСА – выявлялся в разведении в 100000
раз [20 пг/минимальный дот, рис. 1]), варьирующей в зависимости от условий ее возбуждения и накопления, разбавлений,
обработок блотов. Выявлены два типа ФСМ в КЖ: а) мажорный - экзополисахарид/(экзополимерные
соединения)-подобный с низкой способностью к сорбции, с изоэлектрической точкой
в околонейтральной области; б) минорный – с хорошей сорбцией в зоне нанесения,
при разведениях супернатантов в 10-100 раз.
Выраженность
ФСМ у лактобацилл была выше, чем у бифидобактерий, а общее содержание ФСМ (возбуждение
254 нм, фильтр Ethidium Bromide, накопление сигнала 10000-40000
мсек) снижалось у супернатантов КЖ бактерий: 100аш>K3III24>NK1>MC42>Ацилакт. При возбуждении 365 нм воспроизводимость результатов (сходимость
измерений в парах разных партий [бэтчей, batches] образцов КЖ одного и
того же штамма/консорциума раздельно выращенных бактерий одного и того же
штамма) повышалась на фоне снижения интенсивности флюоресценции (рис. 1); при этом ранжирование ФСМ КЖ лактобацилл становилось
более контрастным (сильнее различалось) в группах сравнения: 100аш>K3III24 (группа с повышенными
уровнями ФСМ); МС-42>Ацилакт (группа с относительно сниженными уровнями ФСМ).
2. ФСК КЖ. Использование SYPRO во всех случаях улучшало, полностью или частично
восстанавливало дозовую зависимость проявления флюоресценции в рядах
разбавлений БСА, супернатантов и их концентратов (рис. 1). Поскольку при
разведениях супернатантов КЖ в 100 раз собственная флюоресценция дотов была
слабой или отсутствовала, дальнейшее исследование дотов с высокими
разбавлениями препаратов было возможно и целесообразно с использованием SYPRO, повышающим чувствительность
ТФА и позволяющего регистрировать типы ФСК без вклада собственной флюоресценции.
В случае концентратов супернатантов КЖ
нестабильность (например, у ФСМ в ряду разбавлений концентрата КЖ NK1) и на порядок сниженная чувствительность
устранялись после термообработки блота в присутствии дитиотреитола (результат:
стабильная дозовая зависимость ФСМ в рядах разбавлений, в том числе для
разбавлений в 1000 раз все еще было возможно отчетливое видимое ранжирование
относительного содержания ФСМ в концентратах [возбуждение 254 нм, фильтр Coomassi, 270-750 мсек]: 100аш>NK1>K3III24>Ацилакт).
Сопоставление ранжированных последовательностей указывают
на выраженные различия между высокомолекулярными и низкомолекулярными
флюорофорными компонентами концентратов и супернатантов. Полученные данные
подтверждают,
что ФСМ маскированы в КЖ и концентратах; по мере разбавлений происходит
демаскирование и достижение рефолдингового состояния (активного, с устойчивой
структурой) отдельных молекул, появление/проявление флюоресцентных свойств
молекул; достижение оптимальных/рабочих разведений, обеспечивающих максимальную
флюоресценцию.
Заключение. Предложенный оптимизированный ТФА (без или с
использованием дитиотреитола) для мониторинга и характеристики собственной
флюоресценции нативных ФСМ КЖ и их фракций является высокочувствительным в детекции белковых и небелковых флюорофоров
(маскированных и демаскированных в составе ФСМ и их комплексов), высоконадежным
инструментом экспресс-микроанализа (время ТФА с использованием SYPRO – менее 3 ч) штаммовых различий центрифугатов и фильтратов КЖ бактерий, отслеживания процессов биосинтеза и
гидролиза сигналов в КЖ, выбора штаммов для конструирования консорциумов. Он
перспективен в исследовании культур любых грамположительных бактерий, в том
числе миникультур, а также для микропанельных и биочиповых вариантов ТФА. Использование
модификации ФСМ посредством SYPRO для подтверждения результатов собственной
флюоресценции ФСМ не обязательно в условиях применения установленной
стандартизированной процедуры регистрации собственной флюоресценции известных
препаратов. Определение ФСМ и ФСК
посредством ТФА является важной составляющей общего лабораторного анализа КЖ
бактерий (сделан нами), включающего оценки общего и частично гидролизованного
белка, лектинов, биосурфактантов и других экзополимерных соединений, степень
эмульсифицирования, степени гидролиза компонентов (в том числе присутствия
ароматических аминокислот), потенциального присутствия гликированных
аминокислот/пептидов, сравнительной слабой выраженности пигментирования
супернатантов, наличия эффективных ферментативных гидролитических и
оксидоредуктазных систем (в том числе распределенных в консорциуме
штамм-зависимым образом).
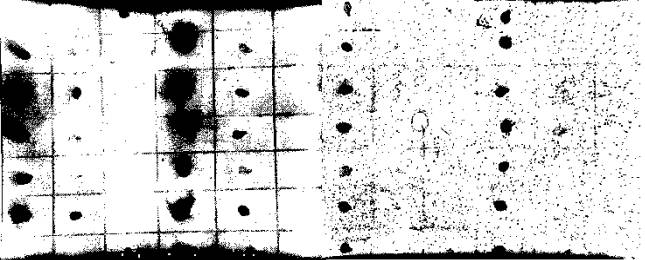
Рис.
1. Флюоресценция блота размером 6 х 7 клеток/дотов: слева - собственная флюоресценция
препаратов, справа - после обработки SYPRO.
Возбуждение 365 нм, фильтр Ethidium Bromide, экспозиция 30000 мсек.
Слева-направо – разбавления препаратов (по 3 клетки на препарат; БСА: 1000,
10000, 100000 раз; супернатанты КЖ: 10, 100, 1000). Сверху-вниз – препараты.
Верхний (1-й) ряд: БСА (3 клетки), БСА-повтор (следующие 3 клетки); 2-й ряд:
Ацилакт, 100аш; 3-й ряд: NK1, K3III24; 4-й ряд: МС-42, K3III24; 5-й ряд: Ацилакт,
МС-42;
6-й
ряд: NK1, 100аш; 7-й ряд: БСА, МС-42.