Экология/4.Промышленная
экология и медицина труда
Ким К.Б., Матчина К.С., Козадерова
О.А., Нифталиев С.И.
Воронежский
государственный университет инженерных технологий, Россия
ОПРЕДЕЛЕНИЕ ОБМЕННОЙ ЕМКОСТИ ИОНООБМЕННЫХ
МЕМБРАН МК-40 И МА-41 В РАСТВОРЕ НИТРАТА
АММОНИЯ
Электромембранные процессы широко используются
современными химическими предприятиями для очистки сточных вод. При
производстве сложного минерального удобрения – нитроаммофоски – одним из
методов обработки сточных вод перед их сбросом в природные водоемы или с целью
очистки для вторичного использования в технологическом цикле является электродиализ
с ионообменными мембранами. Для грамотного проведения этого процесса необходима
предварительная оценка сорбционной емкости ионообменных мембран, применяемых в
электродиализаторе.
Основным компонентом сточных вод от
производства нитроаммофоски (NPK) является
нитрат аммония (Таблица 1). Поэтому задачей настоящего исследования было определение
статической и динамической обменной емкости гетерогенных мембран МК-40 и МА-41 в
модельном растворе NH4NO3 и в реальной сточной воде. В работе применялись
ионообменные мембраны производства ОАО Щекиноазот. Активным компонентом
гетерогенной мембраны типа МК - 40 является сильнокислотный катионообменник
КУ-2-8 [1]. Гетерогенная анионообменная мембрана МА-41 изготавливается из
анионита АВ-17.
На первом этапе исследования была
определена полная обменная емкость мембран, которая учитывает общее количество
поглощенных противоионов и определяется суммой всех активных центров,
вступающих в реакции ионного обмена. Определение полной обменной емкости
мембран проводили по стандартной методике [2]. Образцы катионообменной мембраны
в водородной форме заливали 0,1 М раствором NaOH. В результате ионообменной реакции концентрация щелочи
в растворе уменьшалась.
Таблица 1.
Химический состав сточных вод
от производства NPK, ОАО "Минудобрения", г. Россошь
|
Наименование компонента |
Концентрация,
мг/л |
|
Азот аммонийный |
50
– 200 |
|
Азот нитратный |
20
– 120 |
|
Фосфаты |
0,2 – 2,0 |
|
Хлориды |
1,7 – 7,5 |
|
Сульфаты |
3,1 – 11,8 |
|
Нитриты |
0,24 – 13,1 |
|
Железо общее |
0,01 – 0,25 |
|
Медь |
0,04 |
|
рН |
6,5-8,5 |
При контакте с анионообменником в
гидроксильной форме концентрация кислоты уменьшалась, что позволяло определить
количество сорбированных противоионов и рассчитать емкость мембраны. Полученные
результаты определения полной обменной емкости мембран приведены в таблице 2.
Таблица 2
|
Показатель |
МК-40 |
МА-41 |
|
Полная
обменная емкость по
0,1 М NaOH или HCl, ммоль/г |
2,2 |
2,1 |
|
Краспр NH4+
или NO3- , Краспр = Cмембр/Cраствор
|
|
|
|
модельный раствор NH4NO3
|
204 |
206 |
|
сточная
вода |
102 |
95 |
|
Динамическая обменная
емкость, ммоль/г |
|
|
|
С0(NH4NO3)
= 2 ммоль/л |
1,12 |
1,13 |
|
С0(NH4NO3)
= 12 ммоль/л |
2,21 |
2,10 |
Рабочую обменную емкость определяли для
растворов разных концентраций, это позволило построить изотермы сорбции ионов
мембранами. Одним из способов получения изотерм является метод переменных
концентраций [3], который и применялся в настоящей работе. Определяли содержание
поглощенных ионов по разности между концентрациями исходного (С0) и
равновесного (Cp) растворов или по
десорбции поглощенных ионов. Концентрацию ионов аммония или нитрат-ионов
находили методом прямой ионометрии [4]. Содержание вещества в мембране (q) определяли по формуле
![]() . (2)
. (2)
Полученные нами изотермы
сорбции ионов NН4+ из модельного раствора и сточной воды (рис. 1)
линейны и описываются уравнением Генри [5].
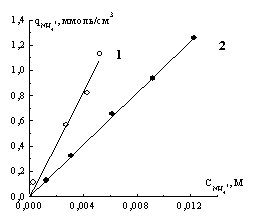
Рис. 1. Изотермы сорбции ионов аммония мембраной МК-40
из модельного раствора нитрата аммония (1) и из сточной воды (2).
Коэффициенты распределения (Краспр) ионов
между мембраной и раствором, которые представляют собой отношение концентрации
вещества в полимере к концентрации его в растворе, приведены таблице 2. В
случае сорбции из индивидуального раствора нитрата аммония коэффициент
распределения почти в два раза выше, чем при сорбции ионов аммония из сточной
воды. Это связано с конкурирующей сорбций других ионов, присутствующих в
сточной воде. Аналогичная ситуация наблюдается и для нитрат-ионов при сорбции
мембраной МА-41 (рис. 2).
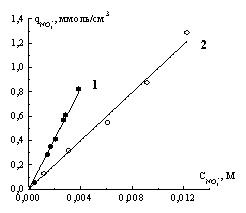
Рис. 2. Изотермы сорбции нитрат-ионов мембраной МА-41 из
модельного раствора нитрата аммония (1) и из сточной воды (2).
Динамический метод состоит в определении
обменной емкости мембран в процессе электродиализа [2]. Эксперимент проводился
в пятисекционной электродиализной ячейке проточного типа (рис. 3). При
наложении разности потенциалов формировались секции обессоливания (2, 4) и
секция концентрирования (3). По разнице концентраций ионов в пермеате и
ретентате, а также исходя из геометрических параметров ячейки и скорости подачи
раствора, мы получили возможность определить сорбционные характеристики
мембран.
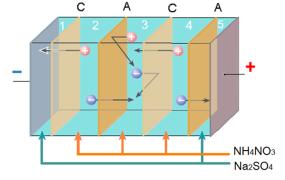
Рис. 3. Электродиализная ячейка. 1 – 5
номера секций, С – катионообменные мембраны, А – анионообменные мембраны.
В результате проведенных исследований
определена полная обменная емкость мембран МК-40, МА-41, рабочая обменная
емкость в статических и динамических условиях. Показано, что при сорбции NН4+ и NO3-
ионов из растворов с концентрацией ≤ 0,012 М полная обменная емкость
достигается только в динамических условиях.
Литература
1.
Иониты.
Каталог. Черкассы: НИИТЭХИМ, 1980. – 32 с.
2.
Глазкова
И.Н. Методы исследования физико-химических свойств ионитовых мембран / И.Н.
Глазкова, Л.П. Глухова. – М.:
ЦНИИатоминформ, 1981. – 96 с.
3.
Самсонов
Г.В. Ионный обмен. Сорбция органических веществ / Г.В. Самсонов, Е.Б.
Тростянская, Г.Э. Елькин. – Л. : Химия, 1969. – 335 с.
4.
Физико-химические
методы анализа / под ред. В.Б. Алесковского – Л. : Химия, 1988. – 376 с.
5.
Воюцкий
С.С. Курс коллоидной химии / С.С. Воюцкий. - М.: «Химия», 1975. - 512 с.