«Высокомощностная брахитерапия источником Ir-192 в лечении рака
предстательной железы»
Павлов А.Ю., Цыбульский А.Д., Дзидзария А.Г., А.А., Исаев Т.К.
ФГБУ Российский научный центр рентгенорадиологии Минздравсоцразвития РФ, Москва
Federal State Establishment Russian Scientific Center of Roentgenoradiology
(RSCRR) of Ministry of Health and Social Development of Russian Federation,
Moscow
Цель исследования: Определить роль высокомощностной брахитерапии в
лечении рака предстательной железы у пациентов низкого, среднего и высокого
риска прогрессирования. Оценить предварительные результаты сочетанной лучевой терапии с применением источника
высокой мощности дозы (Ir-192) в лечении больных раком предстательной железы среднего
и высокого риска прогрессирования.
Материалы и методы: С 2008 по 2010 годы 75 пациентам с диагнозом «рак
предстательной железы» (РПЖ) проводили комбинированное лечение, которое
включало проведение высокомощностной брахитерапии Ir-192 с последующей
дистанционной лучевой терапией (ДЛТ). Все пациенты относились к группе среднего
и высокого риска прогрессирования основного заболевания. 17 пациентам,
относившимся к группе низкого риска прогрессирования, проведена
высокомощностная брахитерапия в монорежиме.
В ходе брахитерапии все пациенты
получали одну фракцию по 10-12 Гр. Среднее значение общей дозы ДЛТ составило
44-46 Гр, по 2 Гр на фракцию.
Брахитерапия в монорежиме
проводилась в виде 3 фракций по 10 Гр с интервалом в 2 недели.
Результаты: Средняя длительность периода наблюдения для групп среднего
и высокого риска прогрессирования составила 31,6 месяц. Показатель 3-летней
безрецидивной выживаемости составил 96,1% и 92,2% для вышеуказанных групп
соответственно. Частота поздних лучевых осложнений III степени (по шкале RTOG)
составила: нижние мочевые пути 5,8 %. Осложнения IV степени отмечено не было.
Со стороны прямой кишки поздний лучевой ректит I степени отмечен у 11% больных, II, III, IV степени отмечено не было.
У пациентов низкого риска
прогрессирования 3-летняя безрецидивная выживаемость составила 100%. Лучевые
осложнения в этой группе пациентов так же были низкими и составили со стороны
поздних генитоуринарных осложнений I ст – 11,7 %, II ст – 5,8%, III - IV степени отмечено не было. Поздние
лучевые осложнения со стороны прямой кишки не выявлены.
Выводы: Высокомощностная брахитерапия показывает
превосходные клинические результаты, оказывая высокое локальное воздействие на
опухоль даже для пациентов высокого риска прогрессирования с минимальными
осложнениями со стороны органов мочеполовой системы и прямой кишки.
Высокомощностная брахитерапия в монорежиме является перспективным направлением
как в качестве основного метода, так и резервной терапии при локальных
рецидивах РПЖ. Высокомощностная брахитерапия входит в перечень услуг,
оказываемых в рамках высокотехнологичной медицинской помощи, и может быть
проведена любому гражданину РФ по квоте при наличии показаний к ее проведению. Учитывая
период полураспада источника Ir-192, 1 источник
позволяет работать в течение 3-4 месяцев, что делает этот метод экономически
выгодным. Наша работа и полученный нами опыт показывает, что внедрение
высокомощностной брахитерапии в регионы РФ и ее широкое использование позволит снизить
нагрузку на онкодиспансеры за счет снижения койко-дня и повысит выживаемость пациентов
и качество жизни с таким распространенным заболеванием как рак предстательной
железы.
Введение:
Очевидно,
что результаты лечения пациентов с локализованным РПЖ напрямую зависит от воздействие
на локальный очаг, даже для пациентов высокого риска прогрессирования [1]. Например, риск возникновения метастазов тесно
связан с проведением локального воздействия на опухоль [2]. Методики, при которых используются дозы
высокой мощности, особенно для опухолей предстательной железы среднего и
высокого риска, характеризуются улучшенным локальным воздействием, поэтому
применение доз высокой мощности при брахитерапии, наружной лучевой терапии или
их комбинации дает хорошие результаты [3,4,5].
Высокомощностная
брахитерапия является средством для абсолютной и радиобиологической эскалации
дозы, что в свою очередь отражается в высоком уровне локального воздействия на
опухоль и низкой токсичности. Как и для всех передовых технологий, для
формирования точной дозы облучения таких сложных структур как предстательная
железа или семенные пузырьки, избегая при этом чрезмерного облучения прямой
кишки, мочевого пузыря и уретры, необходим основательный подход к проведению
предварительного лечебного планирования и тщательное выполнение всех операций.
При высокомощностной
брахитерапии к месту опухоли доставляется радиационная доза > 10 Гр/ч, а
обычно значительно больше. Это требует проведения дистанционного введения
физически небольших источников высокой активности. Современная брахитерапия,
благодаря использованию последних достижений в области визуализации и
компьютерных технологий, позволяет обеспечить высокую эффективность в локальном
воздействии на опухоль и позволяет добиваться хороших результатов даже у
пациентов высокого риска прогрессирования [6,7].
Несмотря на
положительные результаты, достигнутые в ходе применения трёхмерной конформной
лучевой терапии, использование в ходе лечения стандартных радиационных доз
может привести к неудовлетворительным результатам [8]. В нескольких независимых
исследованиях отмечено, что повышение дозы может привести к улучшению
результатов безрецидивной выживаемости для пациентов среднего и высокого риска
[9, 10]. В ходе данных исследований было обнаружено, что использование высоких
радиационных доз (от 72 до 81 Гр) улучшает локальное воздействие на опухоль и
может также способствовать уменьшению риска развития метастазов. Однако
использование доз более 70 Гр может привести к возрастанию генито-уринарных и
желудочно-кишечных осложнений, в частности позднего аноректального кровотечения
и никтурии, в случае если облучению подверглось более 25% объема прямой кишки
[11,12]. Таких негативных последствий можно избежать, если прибегать к
использованию высокодозных технологий ДЛТ, таких как лучевая терапия с
модулированной интенсивностью или комбинированной методики ДЛТ+брахитерапия,
каждая из которых позволяет сберечь соседние органы без увеличения вероятности
возникновения долговременных токсических эффектов прямой кишки [13].
Поскольку
при проведении высокомощностной брахитерапии с визуальным контролем уровни
радиационного облучения снижаются быстро, доза, применяемая для обучения предстательной
железы значительно выше, чем предписанная доза, в то время, как доза облучения
мочевого пузыря и прямой кишки значительно снижена [14,15]. Быстрое снижение
радиационного облучения и уменьшение доз для ключевых органов позволяет достичь
хороших результатов биохимического контроля [16,17].
Для
пациентов групп среднего и высокого риска высокомощностная брахитерапия
проводится либо до, либо после ДЛТ [18] и дает некоторые преимущества по
сравнению с ДЛТ в монорежиме. Последние исследования показали, что одно из
главных преимуществ комбинированного лечения в том, что при дополнительном
проведении высокомощностной брахитерапии доза, приходящаяся на 50% объема предстательной
железы значительно выше (чем при применении только трёхмерной конформной
лучевой терапии) [19]. Другое достоинство данного метода заключается в
возможности контролировать локализацию и время облучения радиоактивного
источника на основании расположения имплантированной иглы [20]. Наконец,
поскольку раковые клетки, как предполагается, имеют низкое значение отношения
вероятностей альфа – и бета – распада подобно нормальным тканям с замедленным
ответом, гипофракционирование дает радиобиологическое преимущество,
заключающееся в возможности хорошего локального воздействия на фоне уменьшения
острой токсичности [21,22,23].
Материалы и методы:
С 2008 по 2010 годы 75 пациентам с
диагнозом «рак предстательной железы» проводили комбинированное лечение,
которое включало проведение высокомощностной брахитерапии Ir-192 с последующей
дистанционной лучевой терапией (на первом этапе проведение одной фракции БТ (Ir-192)
РОД 10-12 Гр. и на втором этапе ДЛТ СОД 44-46 Гр., РОД 2 Гр.). Все пациенты относились к группе
среднего и высокого риска прогрессирования основного заболевания. 17 пациентам,
относившимся к группе низкого риска прогрессирования, проведена
высокомощностная брахитерапия в монорежиме. Из 75 пациентов, участвовавших в
исследовании, 16 (21%) были отнесены к группе среднего риска (T2b-2c, ПСА 10-20
нг/мл, индекс Глисона = 7), и 59 (79%) к группе высокого риска прогрессирования
(T3a-b, и/или ПСА >20 нг/мл, и/или
индекс Глисона ≥ 8).
В ходе высокомощностной брахитерапии
все пациенты получали одну фракцию по 10-12 Гр. Среднее значение общей дозы ДЛТ
составило 44-46 Гр, по 2 Гр на фракцию.
Брахитерапия в монорежиме
проводилась в виде 3 фракций по 10 Гр с интервалом в 2 недели.
Все пациенты
проходили динамическое обследование в периоде после проведения радикального лечения.
Длительность наблюдения после сочетанной лучевой терапии (СЛТ) составила в
среднем 31.6 месяца.
Средний
возраст пациентов 64.2 года (диапазон 48-84 года).
Подготовка пациентов включала в себя общий медицинский
осмотр, пальцевое исследование прямой кишки, развернутый анализ крови с
определением уровня ПСА, рентгенографию органов грудной клетки, ультразвуковое
исследование (УЗИ), остеосцинтиграфию и магнитно-резонансную томографию (МРТ)
органов малого таза.
Всем
пациентам проводилась гормональная терапия в режиме максимальной андрогенной
блокады (МАБ) в течение не менее чем 3-х месяцев до начала СЛТ, и не менее 3-х
месяцев после ее окончания.
Процедура
проведения брахитерапии проводилась под спинальной анестезией в литотомическом
положении, под контролем ТРУЗИ на планирующей системе ONCENTRA (Nucletron B.V.
Veenendaal, Нидерланды).
Высокомощностная
брахитерапия проводилась в виде одного импланта. Предписанные дозиметрические
показатели были: для простаты V100 ≥ 90%, V150
≤ 60%, D90 > 100%, для уретры D crit.
составляла 115%, а для прямой кишки 75%.
Средний
объем предстательной железы составил 27.1 см. куб.
ДЛТ
проводилась через 14 дней и включала в себя облучение всего объема малого таза,
простаты, семенных пузырьков. Облучение проводилось пучками высокоэнергетических
фотонов 6-18 Мэв, по 6 польной программе до суммарной очаговой дозы 44-46 Гр за
22-23 ежедневные фракции.
Методика проведения высокомощностной
брахитерапии источником Ir-192.
После
стандартной подготовки больного к инвазивному трансперинеальному вмешательству
и выполнения анестезиологического пособия
пациент укладывается на операционный стол на спину, к столу
прикрепляются подставки для ног. Ноги пациента фиксируют на подставках в
положении в стороны и вверх на 90 гр в тазобедренном суставе, так, чтобы
промежность находилась на одной прямой с краем операционного стола. Производят
стандартную антисептическую обработку кожи промежности, мошонки, ануса. В мочевой пузырь вводят катетер
Фолея, пережимают его. Ректальный датчик УЗ аппарата, с брахибаллоном,
обработанным гелем для ультразвукового сканирования вводят в прямую кишку
пациента. Датчик закрепляют на степпере. С помощью изменений положения степпера
и заполнения брахибаллона физиологическим раствором добиваются оптимальной
визуализации предстательной железы в проекции виртуальной (изображенной на
мониторе) «координатной брахитерапевтической решетки». Далее осуществляют
непрерывное сканирование предстательной железы от основания к верхушке.
Полученные изображения пересылают в планирующую систему (Рис 1).
Производят
дозиметрическое планирование внутритканевой лучевой терапии. Первый этап –
введение в программу планирования информации о пациенте, физической информации
об источнике (активность), расчетной очаговой дозе. Далее полученные
изображения предстательной железы импортируются в планирующую программу. Второй
этап – стандартизация положения решетки, обведение контуров простаты, уретры,
прямой кишки, семенных пузырьков, при необходимости мочевого пузыря.
Планирование позиций интрастатов, составление «виртуального» дозиметрического
плана внутритканевого облучения (рис.2). 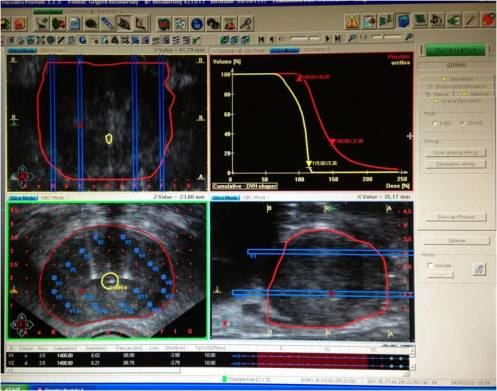
Дозиметрический
контроль проводится на основе 3D сканирования и создания виртуальной трехмерной
модели для проведения лечебного планирования. Для того, чтобы лечение
удовлетворяло требованиям каждого конкретного случая создается, оценивается и
корректируется дозовое распределение. Время облучения источников на каждой
конечной точке оптимизируется для достижения целевого дозового покрытия и
одновременно ограничения облучения здоровых органов.
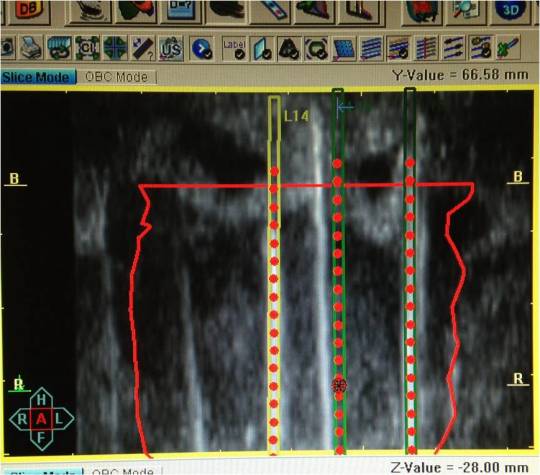
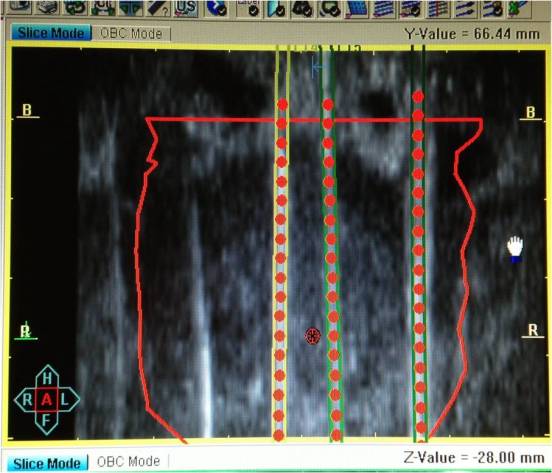
На 3 этапе
согласно намеченному плану в предстательную железу через реальную «координатную
брахитерапевтическую решетку» вводятся интрастаты (стальные ригидные иглы с мандренами) и осуществляется повторное непрерывное
сканирование органа. Далее контуры просканированных органов сравниваются с
исходными данными первого сканирования и, при необходимости, исправляются.
Позиция виртуального интрастата совмещается с реально визуализируемой иглой
(Рис 3,4).
Программа
рассчитывает дозиметрический план – согласно введенным параметрам – расчетная
доза в запланированном объеме облучения, максимальные и минимальные показатели
для критических органов (Рис. 5). 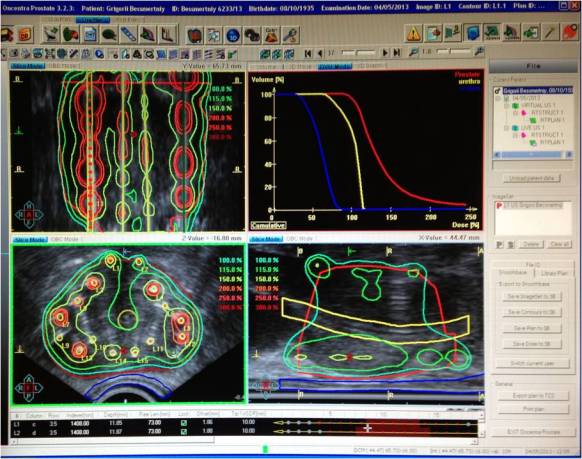
Важно, что
врач, осуществляющий планирование имеет значительный арсенал (в программном обеспечении)
для внесения изменений и улучшений в созданный программой план лучевой терапии.
Таким образом, постимплантационный расчет дозы, который проводится перед
непосредственной доставкой дозы тканям, позволяет корректировать лечебный план
и подстраивать его под индивидуальную анатомию пациента и расположение
катетера, что дает возможность оптимизировать дозовое распределение
органа-мишени с минимальным облучением прилегающих здоровых тканей. Далее
принятый и одобренный план облучения пересылается на рабочую станцию.
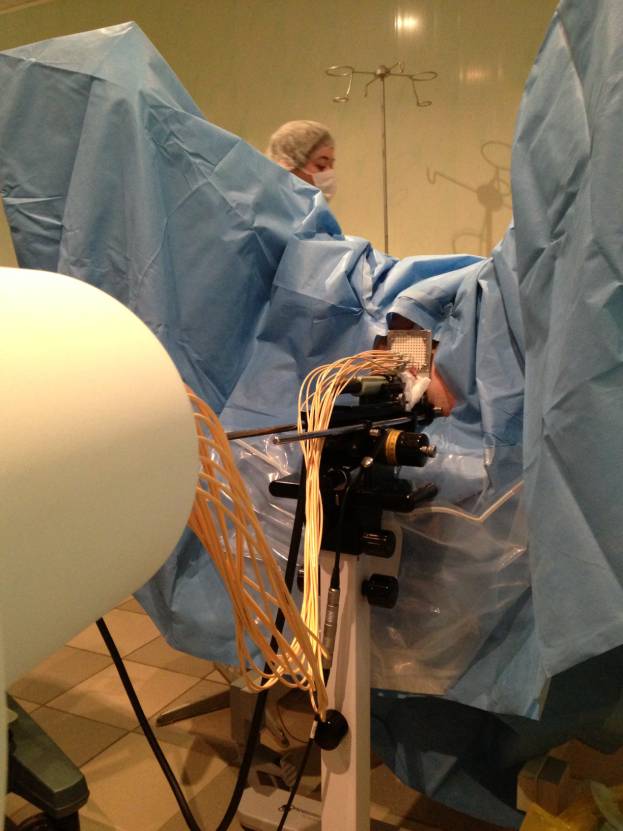
Доставляющие трубки от аппарата (Microselectron) присоединяются к введенным
интрастатам. Происходит сеанс облучения (Рис.6).
Через 2-3
недели выполняется КТ-топометрия и
проводится дистанционная лучевая терапия на весь объем малого таза с включением
зон регионарного лимфооттока (для пациентов группы высокого риска
прогрессирования), либо на простату,
семенные пузырьки и парапростатическую клетчатку (для пациентов группы среднего
риска прогрессирования) разовая очаговая доза составляет 2 Гр, до суммарной
очаговой дозы 44-46Гр.
У пациентов
низкого риска прогрессирования брахитерапия Ir192 проводится в монорежиме в суммарной очаговой
физической дозе 30 Гр за три фракции по
10 Гр и три импланта с интервалом 14 дней между процедурами.
Результаты:
Показатель
трехлетней безрецидивной выживаемости составил 95,6%. У 4 пациентов лечение
было признано безуспешным после 12,14,15 и 17 месяцев наблюдения,
соответственно. У одного подтвержден местный рецидив, у 3 больных возникли
отдаленные метастазы в кости скелета. Все пациенты относились к группе высокого
риска прогрессирования.
Однофакторный
анализ уровня ПСА не показал значительных отличий в результатах лечения для
пациентов с начальным уровнем ПСА ≤ 20 нг/мл, в сравнении с пациентами, у
которых инициальный уровень ПСА > 20 нг/мл.
Аналогично,
анализ индекса Глисона не показал достоверного отличия результатов лечения:
средняя длительность наблюдения после лечения для пациентов с индексом Глисона
менее 8 составила 22.8 месяца по сравнению с 23.1 месяцами у пациентов c
индексом Глисона более 8.
Частота поздних лучевых осложнений
III степени (по шкале RTOG) составила: нижние мочевые пути 5 %, прямая кишка
0.75%. Осложнения IV степени отмечено
не было.
У пациентов
низкого риска, прогрессирование заболевания отмечено не было. Частота поздних лучевых осложнений
III степени (по шкале RTOG) составила: нижние мочевые пути 5,8 % (у 1 больного
стриктура уретры), значимых осложнений со стороны прямой кишки отмечено не
было. Осложнения IV степени отмечено не
было.
Выводы
Методика
сочетанной лучевой терапии с использованием источника высокой мощности дозы
является альтернативной технологией повышения локальной дозы, которая позволяет
подводить к опухоли более высокую биологически эффективную дозу, чем при
использовании только ДЛТ, ограничивая в то же время радиационное облучение
соседних здоровых тканей.
Несмотря на
то, что для окончательного подтверждения наших результатов, необходимо более
длительное обследование пациентов, результаты исследования показывают, что
можно использовать один имплант и одну фракцию для подведения высокой дозы,
достигая при этом результатов, сравнимых с
ранее опубликованными результатами лечения РПЖ.
Применение
высокомощностной брахитерапии в монорежиме у пациентов с низким риском прогрессирования
показал хорошие результаты относительно безрецидивной выживаемости и качества
жизни. Подобранная схема гипофакционирования позволила осуществить эскалацию
локальной дозы облучения при минимизации генитоуринарных и желудочно-кишечных
осложнений.
Высокомощностная
брахитерапия входит в перечень услуг, оказываемых в рамках высокотехнологичной
медицинской помощи, и может быть проведена любому гражданину РФ по квоте при
наличии показаний к ее проведению. Учитывая период полураспада источника Ir-192,
1 источник позволяет работать в течение 3-4 месяцев, что делает этот метод
экономически выгодным. Наша работа и полученный нами опыт показывает, что
внедрение высокомощностной брахитерапии в регионы РФ и ее широкое использование
позволит снизить нагрузку на онкодиспансеры за счет снижения койко-дня (срок
госпитализации в стационаре 2-3 койко-дня) и повысит выживаемость пациентов и
качество жизни с таким распространенным заболеванием как рак предстательной
железы.
Список
литературы:
1. Cahlon O, Zelefsky MJ,
Shippy A, et al. Ultra-high dose (86.4 Gy) IMRT for localized prostate cancer:
Toxicity and biochemical outcomes. Int J Radiat Oncol Biol Phys
2008;71:330-337.
2. Zelefsky MJ, Yamada Y,
Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer:
Impact of dose escalation on biochemical tumor control and distant
metastases-free survival outcomes. Int J Radiat Oncol Biol Phys
2008;71:1028-1033.
3. Hsu IC, Bae K, Shinohara
K, et al. Phase II trial of combined high- dose-rate brachytherapy and external
beam radiotherapy for adeno- carcinoma of the prostate: Preliminary results of
RTOG 0321. Int J Radiat Oncol Biol Phys 2010;78:751-758.
4. Hoskin PJ, Motohashi K,
Bownes P, et al. High dose rate brachytherapy in combination with external beam
radiotherapy in the radical treatment of prostate cancer: Initial results of a
randomised phase three trial. Radiother Oncol 2007;84:114-120.
5. Guedea F, Ventura M,
Mazeron JJ, et al. Patterns of care for brachytherapy in Europe: Facilities and
resources in brachytherapy in the European area. Brachytherapy 2008;7:223-230.
6. Valero J, Cambeiro M,
Galan C, et al. Phase II trial of radiation dose escalation with conformal
external beam radiotherapy and high-dose-rate brachytherapy combined with
long-term androgen suppression in unfavorable prostate cancer: Feasibility
report. Int J Radiat Oncol Biol Phys 2010;76:386-392.
7. Hsu IC, Cabrera AR,
Weinberg V, et al. Combined modality treatment with high-dose-rate
brachytherapy boost for locally advanced prostate cancer. Brachytherapy
2005;4:202-206.
8. Pollack A, Zagars GK,
Starkschall G, et al. Prostate cancer radiation dose response: Results of the
MD Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys
2002;53:1097-1105.
9. Zelefsky MJ, Yamada Y,
Fuks Z, et al. Long-term results of conformal radiotherapy for prostate cancer:
Impact of dose escalation on biochemical tumor control and distant
metastases-free survival outcomes. Int J Radiat Oncol Biol Phys
2008;71:1028-1033.
10.
Vora SA, Wong WW, Schild SE, et al. Analysis of biochemical control and
prognostic factors in patients treated with either low-dose three- dimensional
conformal radiation therapy or high-dose intensity-modulated radiotherapy for
localized prostate cancer. Int J Radiat Oncol Biol Phys 2007;68:1053-1058.
11.
Peeters STH, Heemsbergen WD, van Putten WLJ, et al. Acute and late
complications after radiotherapy for prostate cancer: Results of a multicenter
randomized trial comparing 68 Gy to 78 Gy. Int J Ra- diat Oncol Biol Phys
2005;61:1019-1034.
12.
Brenner DJ, Martinez AA, Edmundson GK, et al. Direct evidence that
prostate tumors show high sensitivity to fractionation (low al- pha/beta
ratio), similar to late-responding normal tissue. Int J Radiat Oncol Biol Phys
2002;52:6-13.
13.
Zelefsky MJ, Levin EJ, Hunt M, et al. Incidence of late rectal and
urinary toxicities after three-dimensional conformal radiotherapy and
intensity-modulated radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2008;70:1124-1129.
14. Galalae RM, Martinez A,
Nuernberg N, et al. Hypofractionated conformal HDR brachytherapy in hormone na
ıve men with localized prostate cancer. Strahlenther Onkol
2006;182:135-141.
15.
Martinez A, Gonzalez J, Stromberg J, et al. Conformal prostate bra-
chytherapy: Initial experience of a phase I/II dose-escalating trial. Int J
Radiat Oncol Biol Phys 1995;33:1019-1027.
16. Guedea F, Ventura M,
Mazeron JJ, et al. Patterns of care for brachy- therapy in Europe: Facilities
and resources in brachytherapy in the European area. Brachytherapy
2008;7:223-230.
17.
Vargas CE, Martinez AA, Boike TP, et al. High-dose irradiation for
prostate cancer via a high-dose-rate brachytherapy boost: Results of a phase I
to II study. Int J Radiat Oncol Biol Phys 2006;66: 416-423.
18.
Galalae RM, Kovacs G, Schultze J, et al. Long-term outcome after
elective irradiation of the pelvic lymphatics and local dose escalation using
high-dose-rate brachytherapy for locally advanced prostate cancer. Int J Radiat Oncol Biol Phys 2002;52:81-90.
19.
Pieters BR, van de Kamer JB, van Herten YR, et al. Comparison of
biologically equivalent dose-volume parameters for the treatment of prostate
cancer with concomitant boost IMRT versus IMRT combined with brachytherapy.
Radiother Oncol 2008;88:46-52.
20.
Vicini FA, Vargas C, Edmundson G, et al. The role of high-dose rate
brachytherapy in locally advanced prostate cancer. Semin Radiat Oncol 2003;13:98-108.
21.
King CR, Fowler JF. A simple analytic derivation suggests that pros-
tate cancer a/ß ratio is low. Int J Radiat Oncol Biol Phys 2001;51:
213-214.
22. Brenner DJ, Martinez AA,
Edmundson GK, et al. Direct evidence that prostate tumors show high sensitivity
to fractionation (low al- pha/beta ratio), similar to late-responding normal
tissue. Int J Radiat Oncol Biol Phys 2002;52:6-13.
23. Valdagni R, Italia C,
Montanaro P, et al. Is the alphaebeta ratio of prostate cancer really low? A
prospective, non-randomized trial comparing standard and hyperfractionated
conformal radiation therapy. Radiother Oncol
2005;75:74-82.