Парченко М.В., д.фарм.н. Панасенко О.І., д.фарм.н. Книш
Є.Г., Парченко В.В.
Запорізький державний медичний університет
ДОСЛІДЖЕННЯ РЕАКЦІЇ ЦИКЛІЗАЦІЇ 5-ГЕТЕРИЛ-4-АМІНО-1,2,4-ТРІАЗОЛ-3-ТІОНІВ ТА
КАРБОНОВИХ КИСЛОТ
Незаперечні успіхи
сучасної вітчизняної хімії гетероциклічних сполук, пов'язані насамперед з
впровадженням перспективних молекул у практику медицини, фармації, ветеринарії,
є актуальними, мають теоретичну та практичну значимість [8, 9, 11].
Особливу увагу серед
нітрогенвмісних гетероциклічних систем займають 1,2,4-тріазоли. Літературні
джерела свідчать, що ядро 1,2,4-тріазолу є фрагментом багатьох відомих
лікарських препаратів [7, 10] та біологічно активних сполук [1-3, 10-14].
Моделювання ядра 1,2,4-тріазол-3-тіону шляхом введення в різні положення цієї
системи аліфатичних, ароматичних, гетероциклічних замісників потенційно може
призвести до появи нових молекул біологічно активних речовин [4, 5, 11, 14].
Подальші дослідження деяких реакцій перетворення 4-, 5-заміщенних
1,2,4-тріазол-3-тіону викликає інтерес не лише у фармакологів, а у
хіміків-синтетиків, тому що реакції можуть проходити по різному [6, 9, 11, 14].
Окремо слід
відзначити реакції циклізації деяких похідних 3-тіо-1,2,4-тріазолів. Подібні
реакції знаходять широке застосування в сучасному органічному синтезі [9, 11,
14]. Продукти перетворень широко використовуються в народному господарстві, а
деякі з них можуть бути застосовані для подальшого пошуку фармакологічно
активних молекул та створення на їх основі нових вітчизняних лікарських засобів
[14].
Метою нашої роботи було
дослідження реакції циклізації нових 5-гетерил-4-аміно-1,2,4-тріазол-3-тіонів
із карбоновими кислотами в середовищі POCl3 (рис.1).
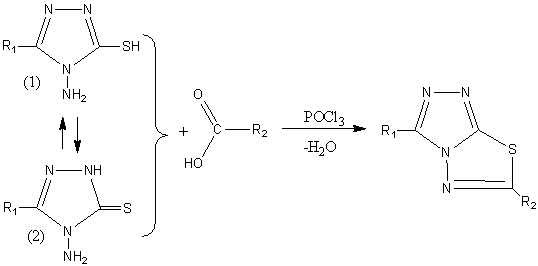
R1=Het, R2=Ar
Рис. 1. Взаємодія
5-гетерил-4-аміно-1,2,4-тріазол-3-тіонів із карбоновими кислотами
Матеріали та методи дослідження.
Літературні джерела свідчать [15, 16], що подібні реакції можуть проходити з
утворенням відповідних тіадіазолів. Відомо також існування для 5-R-4-аміно-3-тіонів різних таутомерних форм (1, 2 рис. 1) в
залежності від значення pH середовища [4, 5, 11, 14]. Проводячи реакції
циклізації, нашу увагу привернула таутомерна форма тіолу, тому що замикання
циклу тіадіазолу проходить саме за участі протону тіогрупи. Іноземні учені за
допомогою комплексних фізико-химічних методів аналізу доводять будову
синтезованих тіадіазолів [15, 16].
Нами з метою
розширення арсеналу потенційних біологічно активних молекул синтезовано
нові 6-арил-3-гетерил-[1,2,4]тріазоло[3,4-b][1,3,4]тіадіазоли.
Реакції проходять за схемою рисунку 1.
Реакційну суміш еквівалентних кількостей
відповідних 5-гетерил-4-аміно-1,2,4-тріазол-3-тіонів та карбонових кислот у
надлишку POCl3 нагрівають на водяній бані 3 години. Після розчинення суміші, випадає осад. У
кожному випадку суміш виливають на лід, додають водний розчин амоніаку до
нейтрального середовища, осад відфільтровують. Отримують індивідуальні сполуки,
які перекристалізовано із ізопропанолу.
Аналізуючи
результати квантово-хімічних розрахунків молекул вихідних сполук слід
зазначити, що реакція може проходить саме за схемою рисунку 1. Будова
синтезованих сполук (рис. 1) підтверджена комплексними фізико-хімічними
методами аналізу, а їх індивідуальність – хроматографічно.
Елементний склад
нових сполук встановлено на елементному аналізаторі ELEMENTAR vario EL cube
(стандарт – сульфаніламід). ІЧ-спектри записувались у таблетках калію броміду
(концентрація речовини 1%) на спектрофотометрі Specord M-80 в області 4000-500
см-1 (умови сканування: щільова програма 3.0, постійна часу –
τ=3 с, час сканування 33 хв). Таблетки готувалися спільним розтиранням 200
мг калію броміду і 2 мг досліджуваної сполуки з наступним пресуванням.
ПМР-спектри
реєструвались на спектрофотометрі ядерного магнітного резонансу «Varian
VXR-300», розчинник DMSO-D6, внутрішній стандарт – тетраметилсилан.
Хромато-мас-спектри реєстрували на спектрометрі Agilent 6890N/5973N/FID
виробництва Agilent Technologies, з мікропотоковим перемикачем Діна. Колонка №
1 – кварцева капілярна НР-5MS 0.25 мм.х30 м., вихід колонки під’єднано до
детектора іонізації в полум’ї, № 2 – кварцева капілярна DB-17MS 0.25 ммх30 м,
кінець колонки безпосередньо входить в масспектрометр. Температура інжектора –
250°С, інтерфейса масспектрометра ( Transfer line ) – 280°С, джерела іонів –
230°С, квадруполя – 150°С. Режим іонізації – електронний удар, енергія
електронів – 70 еВ, напруга електропомножувача – на 200 В більше ніж при Autotune (автоматична настойка шкали мас).
Діапазон сканування 40-750 а. о. м., поріг – 110, швидкість сканування – 2.11
скан/сек. Режим програмування температури термостата: 70°С – 2 хв, потім підйом до 210°С зі швидкістю – 45°С/хв, потім підйом до
310°С зі швидкістю – 06°С/хв, та
витримування при цій температурі 18.22 хв. Тиск газу – носія (гелію) на вході в
першу колонку – 26.00 psi, другу – 19.30 psi.
Мас-спектральні дослідження синтезованих сполук
проводили на приладі Varian 1200L, іонізація здійснюється електронним ударом
(70 eV) при прямому введенні зразка. Температура іонного джерела 200°С;
нагрівання відбувається від 25°С до
390°С зі швидкістю 30°С/хв. Хроматографію у тонкому шарі сорбенту проводили на пластинках силікагель
60 ALUGRAMSill G\UV254 (алюм. підкл. 20х20) (Махерей-Нагель), або силікагель 60
ALUGRAMSill G\UV254 (алюм. підкл. 10х20) (Махерей-Нагель).
Отримані результати та їх обговорення
Аналіз ПМР-спектрів
синтезованих сполук чітко вказує на проходження реакції і утворення саме
6-арил-3-гетерил-[1,2,4]тріазоло[3,4-b][1,3,4]тіадіазолів (рис. 2). Відсутність
сигналів протонів функціональних замісників, а саме –NH2 та –SH груп вихідних сполук –
5-гетерил-4-аміно-1,2,4-тріазол-3-тіонів підтверджує проходження реакції.
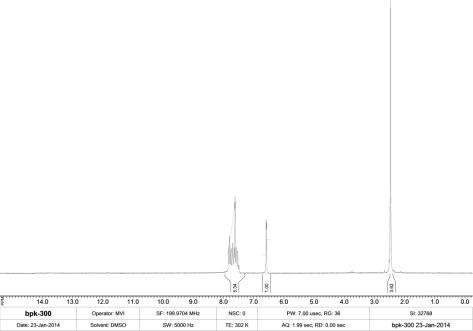
Рис. 2. ПМР-спектр
6-(3-фторфеніл)-3-(2-метилфуран-3-іл)-[1,2,4]тріазоло[3,4-b][1,3,4]тіадіазолу
Остаточно будова
синтезованих сполук підтверджена результатами хромато-мас спектрів. У кожному
випадку зафіксовано лише один пік із відповідним значенням m/z. Подальша фрагментація молекул під дією електронного удару призводить до
руйнування молекул сполук та утворення відповідних йонів.
Висновки
За результатами
досліджень синтезовано ряд нових
6-арил-3-гетерил-[1,2,4]тріазоло[3,4-b][1,3,4]тіадіазолів реакцією вихідних
5-гетерил-4-аміно-1,2,4-тріазол-3-тіонів із карбоновими кислотами. Будова
синтезованих сполук підтверджена комплексними фізико-хімічними методами
аналізу, а їх індивідуальність – хроматографічно.
Література
1.
Вивчення гіпоглікемічної активності похідних
1,2,4-тріазолу при експериментальній гіперліпідемії / Є. С. Пругло, І. М.
Білай, Р. О. Щербина А. Г. [та ін.] // Фармац. журн. – 2011. – № 1. – C.
74-78.
2.
Вивчення фізико-хімічних та біологічних властивостей
2-[5-(2-фуран-2-іл)-4-(метил, 2-,3-метилфеніл,
2-метоксифеніл)-1,2,4-тріазол-3-ілтіо]-1-арилетанонів та S-алкіл-,
арил-, гетерилпохідних 5-(2-фуран-2-іл)-4-(метил, 2-, 3-метилфеніл,
2-метоксифеніл)-1,2,4-тріазол-3-тіонів / Парченко В. В., Панасенко Т. О., Книш
Є. Г. [та ін.] // Материалы Всеукр. науч.-практ. конф. с междунар. участием
«Лекарства – человеку». – X., 2007. – С. 84-85.
3.
Каплаушенко А. Г. Взаємозв’язок між гострою токсичністю й
дослідженими видами фармакологічної активності 4-моно- й 4,5-дизаміщених
1,2,4-тріазол-3-тіону та їх S-похідних / А. Г. Каплаушенко //
Запорож. мед. журн. – 2010. – № 4. – C. 80-82.
4.
Каплаушенко А. Г. Синтез, будова і біологічна активність
похідних 4-аміно- та 4,5-дизаміщених 1,2,4-тріазол-3-тіону: дис. … д-ра фарм.
наук. / А. Г. Каплаушенко. – Запоріжжя., 2012. – 396 с.
5.
Маковик Ю. В. Синтез, фізико-хімічні та біологічні
властивості S-похідних 5-(3-піридил)- та 5-(3-піридил)-4-феніл-1,2,4-тріазоліл-3-тіона :
дис. … канд. фармац. наук / Ю. В. Маковик. – К., 2008. – 223 с
6.
Маковик Ю. В. Синтез, перетворення, протимікробна та
протигрибкова активність у ряді 5-(піридин-3-іл)-4-R-1,2,4-тріазол-3-тіонів
/ Маковик Ю. В., Книш Є. Г., Панасенко О. І. // Медична хімія. – 2007. – Т. 9,
№ 2. – С. 95-98.
7.
Машковский
М. Д. Лекарственные средства : в 2 т. / М. Д. Машковский. – М. : Медицина,
1986. – Т. 1. – 621 с. ; Т. 2. – 575 с.
8.
Нейропротективна
активність S-похідних 1,2,4-тріазолу / Р. О. Щербина, В. В. Парченко, С. В.
Павлов [та ін.] // Запорож. мед. журн. – 2011. – Т. 13, № 1. – С. 94-97.
9.
Общая
органическая химия. Т8: Азотистые гетероциклы /(Под. ред. Н.К. Кочеткова. — М.:
Химия, 1995. — 443 с.
10.
Парченко В. В. Нові S-похідні 1,2,4-тріазолу, як
потенційні оригінальні вітчизняні ветеринарні лікарські засоби / В. В. Парченко
// Фармац. журн. – 2012. – № 3. – С. 42-48.
11.
Парченко В. В. Синтез, фізико-хімічні та біологічні
властивості похідних 1,2,4-трiазол-3-тioну, які містять ядро
фурану: дис. … канд. фарм. наук / В. В. Парченко. – К., 2006. – 207 с.
12.
Парченко В. В. Синтез, фізико-хімічні та біологічні
властивості нових S-похідних 1,2,4-тріазолу, фрагментом молекул яких є залишки фурану /
Парченко В. В., Панасенко О. І., Книш Є. Г. // Сучасні проблеми біології,
екології та хімії. – Запоріжжя, 2012. – С. 330.
13.
Парченко В. В. Фізико-хімічні властивості та гостра
токсичність похідних 3-ацилалкілтіо-1,2,4-тріазолів / В. В. Парченко, О. І.
Панасенко, Є. Г. Книш //
Фармац. часопис. – 2007. – Вип. 2 (2). – С. 41-43.
14.
Панасенко О.І.
Синтез, перетворення, фізико-хімічні та біологічні властивості аміно- і
тіопохідних 1,2,4-триазолу: Дис. докт. фармац. наук.-Київ, 2005.- 423 с.
15. Efficient synthesis and insecticidal activity of novel
pyridin-3-yl-[1,2,4]triazolo[3,4-b][1,3,4]thiadiazoles
/ Q. Qian, Y. Zhu, M. Zhang [et al.] // Monatsh Chem. – 2013. – Vol. 144, issue
2. – P. 231–236.
16. Hunashal Rajesh D.
One pot synthesis of 3-(substituted phenoxymethyl)-6-phenyl/substituted
phenoxymethyl-1,2,4-triazolo[3,4-B][1,3,4]triadiazole derivatives as
antimicrobial agents / Hunashal Rajesh D. // Int. J. of Pharma and Bio
Sciences. – 2012. – Vol. 3 (4). – P. 183–192.