Береснев
А.И. , Ерошевская Л.А., Кузьмина О.Н., Орлова Л.И.,
Романова Л.В., Квач С.В., Зинченко А.И.
Институт микробиологии НАН Беларуси, Минск, Беларусь
препаративный
Синтез гуанинарабинозида с использованием рекомбинантных
бактериальных
ферментов
Как известно, модифицированные
аналоги гуанозина служат основой субстанций ряда противовирусных и
противоопухолевых препаратов. Кроме того, эти соединения используются в
качестве исходных субстратов при синтезе олигонуклеотидных лекарственных
субстанций [1, 2]. Гуанинарабинозид (9-ß-D-арабинофуранозилгуанин; ара-Г), наряду с его
более водорастворимым вариантом – 6-метокси-ара-Г (неларабин), обладает мощным селективным
цитотоксическим эффектом [3] в отношении Т-лейкемических клеток.
Химические методы синтеза ара-Г
характеризуются многостадийностью и низкими выходами конечного продукта. Кроме
того, они предусматривают использование экологически небезопасных реагентов [4,
5].
Уже сравнительно продолжительное
время рядом исследователей используется удобная альтернатива химическим
способам синтеза модифицированных пуриновых нуклеозидов, основанная на
применении метода ферментативного трансгликозилирования [6, 7]. Открытие этого
процесса позволило решить ряд проблем, характерных для химических методов:
синтез нуклеозидов проводится в водных растворах (мягкие условия), фермент
осуществляет реакцию с абсолютной регио- и стереоспецифичностью, что не
приводит к образованию трудноразделяемых изомеров.
Однако следует отметить, что,
поскольку в основу всех упомянутых выше способов ферментативного получения нуклеозидов
положена обратимая реакция трансгликозилирования, это в большинстве случаев делает
невозможным достижение высоких выходов целевого продукта, если исходные
субстраты берутся в эквимолярных количествах. Поэтому, например, в способе получения
аденинарабинозида (ара-А) из урациларабинозида (ара-У) и аденина [8, 9] для
повышения выхода целевого нуклеозида в реакционную смесь вносят избыточное
(обычно 3-кратное) количество сравнительно хорошо растворимого нуклеозида, что
способствует сдвигу равновесия процесса в сторону прямой реакции, однако приводит
к значительному расходу такого соединения. Кроме того, рассмотренные способы
характеризуются низкими волуметрическими выходами целевых продуктов. Этот
недостаток обусловлен тем, что, как правило, процесс ведут при сравнительно низких
концентрациях исходных реагентов.
Арабинозиды ранее синтезировались путем трансгликозилирования с использованием
уридинфосфорилазы (УРФ) из Escherichia coli и ара-У в качестве донора сахара [7]. Utagawa [6] сообщил о получении арабинозидов аденина
и других пуринов, используя целые клетки Enterobacter
aerogenes (70‒90% выход за 24 ч). Medici [10] показал, что Enterobacter gergoviae синтезирует арабинозид 2,6-диаминопурина
(ара-ДАП) с 72% выходом за 48 ч. Ара-ДАП также был синтезирован с помощью Enterobacter aerogenes с 90% конверсией
за 48 ч [11].
Иную стратегию, основанную на
сочетании действия двух ферментов целых клеток, чтобы выполнить
последовательность реакций трансгликозилирования и дезаминирования,
использовали для синтеза ара-Г [12]. Стадия дезаминирования ара-ДАП была
проведена с помощью аденозиндезаминазы (АД) из Arthrobacter oxydans [13] или аденилатдезаминазой, продуцируемой Aspergillus oryzae [11]. Волуметрический
выход ара-Г составил 1,02 г/л (при степени конверсии 2,6-диаминопурина в ара-Г
36%).
По мнению авторов сообщения [14], они впервые использовали иммобилизованные
целые клетки в качестве биокатализатора при синтезе пуриновых арабинозидов
через трансгликозилирование. Клетки Citrobacter koseri иммобилизовали с помощью метода включения в
гель агарозы. При объеме реакционной смеси 150 мл получили: арабинозид
2-фтораденина (флударабин) (58% выход за 14 ч), ара-А (видарабин; 71% за 26 ч)
и ара-ДАП (77% за 24 ч).
При синтезе ара-Г в качестве донора гуанина использовали гуанозин,
из-за слабой растворимости этого основания при рН 7. Выход ара-Г достиг 27% за
12 ч (по ВЭЖХ). Использовалась концентрация азотистых оснований – 10 мМ, 20 мМ Ара-У
(для ара-А) и 30 мМ Ара-У (для ара-ДАП). Волуметрические выходы ара-А, ара-Г и
ара-ДАП составили 1,9, 0,8 и 2,2 г/л, соответсвенно.
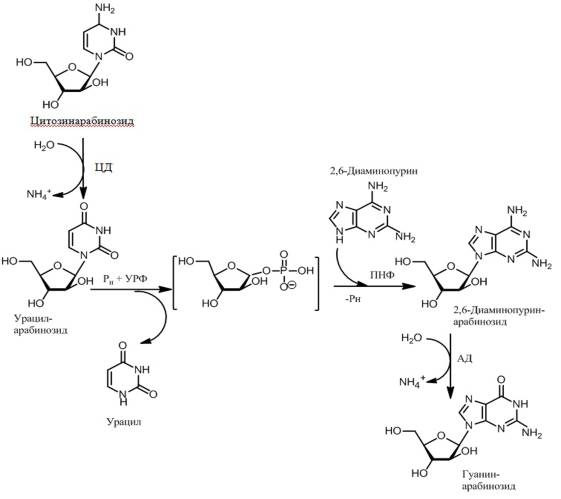 Ранее
мы разработали ферментативные методы получения ряда природных нуклеозидов и их
модифицированных аналогов (в том числе и ара-Г [15]) с использованием ферментов,
которые продуцируют мутантные штаммы бактерий [16]. В настоящей работе мы осуществили
препаративный синтез ара-Г с помощью УЗ-лизатов клеток сконструированных
штаммов E. coli, продуцирующих рекомбинантные цитидиндезаминазу (ЦД), уридинфосфорилазу
(УРФ), пуриннуклеозидфосфорилазу (ПНФ) и АД. Условия культивирования генно-инженерных
бактерий в Биотехнологическом центре Института микробиологии НАН Беларуси и
получение ферментных препаратов описаны нами ранее [17]. Cхема синтеза ара-Г представлена на рисунке.
Ранее
мы разработали ферментативные методы получения ряда природных нуклеозидов и их
модифицированных аналогов (в том числе и ара-Г [15]) с использованием ферментов,
которые продуцируют мутантные штаммы бактерий [16]. В настоящей работе мы осуществили
препаративный синтез ара-Г с помощью УЗ-лизатов клеток сконструированных
штаммов E. coli, продуцирующих рекомбинантные цитидиндезаминазу (ЦД), уридинфосфорилазу
(УРФ), пуриннуклеозидфосфорилазу (ПНФ) и АД. Условия культивирования генно-инженерных
бактерий в Биотехнологическом центре Института микробиологии НАН Беларуси и
получение ферментных препаратов описаны нами ранее [17]. Cхема синтеза ара-Г представлена на рисунке.
Рис. 1. Схема однореакторного ферментативного
синтеза ара-Г
Реакционную смесь объемом 920 мл, состоящую из 0,4 М ара-Ц, 30 мМ калий-фосфатного буфера (КФБ) (рН 7,0) и 20 ед/мл ЦД, инкубировали при 37°С в течение 21 ч, после чего прогревали при 50°С в течение 1 ч для удаления аммиака, образовавшегося в процессе дезаминирования нуклеозида. К полученному раствору добавили 1 М КФБ (рН7,0) до конечной 0,125 М концентрации, 2,6-диаминопурин до 0,3 М, 190 ед/мл ПНФ и 75 ед/мл УРФ. Смесь инкубировали в течение 24 ч при 55°С, после чего доводили объем до 5 л и прогревали при 85°С до полного растворения образовавшегося осадка с последующим охлаждением раствора до 4°С для кристаллизации синтезированного ара-ДАП.
К отфильтрованному осадку ара-ДАП добавляли 2,2 л 50 мМ Трис-HCl (рН 7,0) и 1000 ед/мл АД. Смесь инкубировали при 37°С в течение 48 ч после чего доводили объем полученной суспензии до 8,8 л, прогревали при 85°С до полного растворения осадка и охлаждали до 4°С для кристаллизации полученного ара-Г. Контроль накопления продуктов реакции проводили с применением тонкослойной хроматографии в системе растворителей хлороформ : метанол : 0,4 М аммиак в соотношении 15 : 5 :1 (об/об).
Дезаминирование ара-Ц протекало с 99–100% выходом. Конечный выход ара-ДАП
в реакциях тандемного трансгликозилирования составил 97–99%. Дезаминирование ара-ДАП
АД катализировала с более чем 99% выходом ара-Г. Суммарная степень трансформации исходного ДАП в ара-Г составила 97%. Волуметрический
выход ара-Г превысил 81,6 г/л.
В заключение следует подчеркнуть,
что предлагаемый способ синтеза ара-Г отличается от известных аналогов высокой
степенью трансформации исходных субстратов в целевой продукт, и, самое важное,
резко повышенным волуметрическим выходом этого продукта.
Литература:
1.
Herrstrom Sjoberg A., Wang L.,
Eriksson S. Antiviral guanosine analogs as
substrates for deoxyguanosine kinase: implications for chemotherapy // Antimicrob. Agents
Chemother. 2001. Vol. 45, N 3. P. 739–742.
2. Mikhailopulo I.A., Miroshnikov A.I. Biologically important nucleosides: modern
trends in biotechnology and application // Mendeleev Commun. 2011. Vol. 21. P. 57–68.
3. Buie L.W., Epstein S.S., Lindley C.M. Nelarabine: a novel purine antimetabolite antineoplastic agent // Clin. Ther. 2007. Vol. 29, N 9. P. 1887–1899.
4.
Montgomery J.A.,
Shortnacy-Fowler A.T., Clayton
S.D. et al. Synthesis and biologic activity of 2'-fluoro-2-halo derivatives of
9-β-D-arabinofuranosyladenine
// J. Med. Chem. 1992. Vol. 35,
N 2. P. 397–401.
5.Yu
X.J., Li G.X., Qi X.X., Deng Y.Q. Stereoselective synthesis of 9-β-D-arabianofuranosyl guanine and
2-amino-9-(β-D-arabianofuranosyl)purine // Bioorg.
Med. Chem. Lett. 2005. Vol. 15, N 3. P. 683–685.
6. Utagawa T.
Enzymatic preparation of nucleoside antibiotics // J. Mol. Catal. B:
Enzym. 1999. Vol. 6.P.
215–222.
7. Krenitsky T.A.,
Koszalka G.W., Tuttle J.V et al. An enzymatic synthesis of purine
D-arabinonucleosides // Carbohydr. Res. 1981. Vol. 97. P. 139–146.
8. Ерошевская Л.А., Барай В.Н., Зинченко А.И. и др. Препаративный синтез противовирусного нуклеозида 9-b-D-аденинарабинозида с помощью бактериальных клеток // Антибиот. мед. биотехнол. 1986. Т. 31, № 3. С. 174–178.
9. Wei X.K., Ding
Q.B., Zhang L. et al. Induction of
nucleoside phosphorylase in Enterobacter
aerogenes and enzymatic synthesis of adenine arabinoside // J. Zhejiang Univ. Sci. B. 2008. Vol.
9, N 7. Р. 520–526.
10. Medici R.,
Lewkowicz E.S., Iribarren A.M. Microbial synthesis of 2,6-diaminopurine nucleosides
// J. Mol. Catal. B: Enzym. 2006. Vol.
39. P. 40–44.
11. Wei X., Ding Q.,
Ou L. et al. Two-step enzymatic synthesis of guanine arabinoside // Chin. J. Chem.
Eng. 2008. Vol. 16. P.
934–937.
12.
Medici R., Iribarren A.M., Lewkowicz E.S. Synthesis of 9-β-D-arabinofuranosylguanine
by combined use of two whole cell biocatalysts // Bioorg. Med. Chem. Lett. 2009. Vol.
19, N 15. P. 4210–4212.
13. Medici R.,
Lewkowicz E.S., Iribarren A.M. Arthrobacter oxydans as a biocatalyst for purine
deamination // FEMS Microbiol. Lett.
2008. Vol. 289. P. 20–26.
14. Nуbile M., Medici R., Terreni M., Lewkowicz E.S.,
Iribarren A.M. Use of Citrobacter koseri
whole cells for the production of arabinonucleosides: A larger scale approach
// Process Biochem. 2012. Vol. 47. P. 2182–2188.
15. Zinchenko A.I., Barai
V.N., Bokut S.B. et al. Synthesis of 9-(β-D-arabinofuranosyl)guanine using whole cells of Escherichia coli // Appl. Microbiol. Biotechnol.
1990. Vol. 32, N 3. Р. 658–661.
16.
Barai V.N., Zinchenko A.I., Eroshevskaya L.A. et al. An universal biocatalyst
for the preparation of base- and sugar-modified nucleosides via an enzymatic transglycosylation //
Helvetica Chim. Acta. 2002. Vol. 85, N
7. Р. 1901–1908.
17. Береснев А.И., Ерошевская
Л.А., Квач С.В. и др. Ферментативный способ получения кинетинрибозида // Dny vedy – 2013: materialy
IX Mezinarodni vedecko-prakticka konference, Praha, 27.03–05.04.2013. Vol. 30. P. 54–57.