д.х.н. 1Цыганкова
Л.Е, д.х.н.. 2Вигдорович В.
И, д.х.н. 3Шель Н.В.,
к.х.н. 1Урядников
А.А., к.х.н. 1Есина М.Н., асп. 2Беленова
С.В.
1Тамбовский государственный университет имени Г.Р. Державина
2ФГБНУ «Всероссийский научно-исследовательский институт использования
техники и нефтепродуктов в сельском хозяйстве»
3Тамбовский государственный технический университет
Сорбция катионов Cu(II) концентратом
глауконита из непроточных нитратных растворов
Цель настоящей работы – исследование влияния рН,
предварительной термической подготовки
сорбента, замены катионов Cu(II) на
их аммиачные комплексы на эффективность
их сорбции 95%-м концентратом глауконита из непроточных перемешиваемых
нитратных растворов. Исходная концентрация Cu(II) -
220 мг/л, перемешивание магнитной мешалкой, комнатная температура.
Содержание Cu(II)
на всех этапах эксперимента оценивали обратным комплексометрическим титрованием
с трилоном Б в присутствии мурексида. Cu(NO3)2 готовили
растворением меди (99,94 масс. % основного вещества) в HNO3 в фарфоровом тигле с
последующим выпариванием и переносом в фиксированный объем дистиллированной
воды. Оцениваемый коэффициент извлечения (ρ) представляет собой отношение
разности исходной и достигнутой к фиксированному моменту времени концентрации
катиона Cu(II) к его исходному содержанию. Величины
ρ приведены для условий достижения равновесных концентраций Cu(II).
Время достижения равновесия не превышало 40 минут. В качестве индифферентного
электролита использованы добавки 10-3 моль/л или 10-2
моль/л нитрата калия. Адсорбент - исходный концентрат глауконита(без
предварительной дополнительной подготовки) и продукт, подвергнутый термической
обработке в течении 20 минут при 100 либо 300![]() .
.
Результаты,
полученные при исходной величине рН растворов, близкой к 5, которая достигается
за счет гидролиза катионов Cu(II), но без дополнительного подкисления,
приведены на рис. 1. Их анализ показывает, что в
отсутствие индифферентного электролита коэффициент извлечения сорбентом
катионов Cu(II) невелик и не превышает
50%. Термическая обработка глауконита при 100![]() его несколько понижает (
его несколько понижает (![]() 42%), а при 300
42%), а при 300![]() - напротив, вновь повышает (
- напротив, вновь повышает (![]() 50%). В целом же, наличие подобной предшествующей подготовки
принципиально не изменяет сорбционную способность глауконита.
50%). В целом же, наличие подобной предшествующей подготовки
принципиально не изменяет сорбционную способность глауконита.
.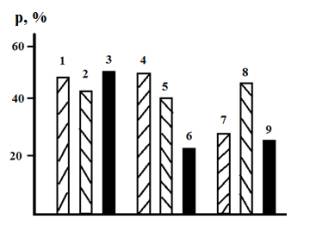
Рис. 1. Влияние температуры термической обработки сорбента и добавки KNO3 на коэффициент извлечения катионов Cu(II)
концентратом глауконита из раствора с исходным рН = 5. 1, 4 и 7 – термическая
обработка сорбента отсутствует; 2, 5 и 8 - 100![]() ; 3, 6 и 9 - 300
; 3, 6 и 9 - 300![]() . СKNO3, моль/л:
1 -3 – отсутствует; 4 - 6 –5·10-3; 7 -9 -1·10-2.
. СKNO3, моль/л:
1 -3 – отсутствует; 4 - 6 –5·10-3; 7 -9 -1·10-2.
Введение 5·10-3 моль/л нитрата калия изменяет
характер влияния термической обработки. Теперь наибольшая величина ρ
наблюдается при отсутствии предварительного нагрева, а выдержка сорбента при
100![]() понижает
понижает ![]() на 9 – 10%. Рост температуры до 300
на 9 – 10%. Рост температуры до 300![]() ведет к уменьшению
ведет к уменьшению ![]() до 22%. Дальнейшее повышение концентрации нитрата калия вдвое с
подобным же возрастанием ионной силы раствора значительно снижает сорбционную
способность концентрата, не прошедшего термическую обработку, а выдержка
сорбента при 100
до 22%. Дальнейшее повышение концентрации нитрата калия вдвое с
подобным же возрастанием ионной силы раствора значительно снижает сорбционную
способность концентрата, не прошедшего термическую обработку, а выдержка
сорбента при 100![]() его заметно повышает (столбцы 7 и 8, рис. 1) В целом, уровень сорбции
ионов Cu(II) во всех изученных случаях
достаточно низок, а
его заметно повышает (столбцы 7 и 8, рис. 1) В целом, уровень сорбции
ионов Cu(II) во всех изученных случаях
достаточно низок, а ![]() 50%.
50%.
Подщелачивание раствора аммиаком до исходной величины рН,
равной 7, существенно меняет наблюдаемую картину (рис. 2). В отсутствие
индифферентного электролита величина ![]() составляет 85% и систематически возрастает с проведением
термической обработки при 100 и 300
составляет 85% и систематически возрастает с проведением
термической обработки при 100 и 300![]() соответственно до 90 и 93%. Наличие
5·10-3 моль/л нитрата калия позволяет довести значение коэффициента
извлечения до 98% независимо от проведения предварительной термообработки или
её отсутствия. Рост концентрации нитрата калия
снижает
соответственно до 90 и 93%. Наличие
5·10-3 моль/л нитрата калия позволяет довести значение коэффициента
извлечения до 98% независимо от проведения предварительной термообработки или
её отсутствия. Рост концентрации нитрата калия
снижает ![]() на 2 – 3% (рис. 2). Наличие аммиака приводит к образованию
аммиакатов меди [1, 2]. Согласно [1], по реакции:
на 2 – 3% (рис. 2). Наличие аммиака приводит к образованию
аммиакатов меди [1, 2]. Согласно [1], по реакции:
![]() , (1)
, (1)
образуется
тетрамин, все внутрисферные лиганды которого равноценны. Величина к
подтверждается и сопоставлением констант нестойкости комплексных катионов
(таблица 1).
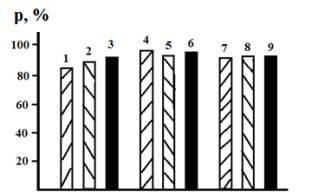
Рис. 2. Влияние температуры
термической обработки сорбента и добавки KNO3 на коэффициент извлечения катионов Cu(II)
концентратом глауконита из раствора с исходным рН=7. 1, 4 и 7 – термическая
обработка сорбента отсутствует; 2, 5 и 8 - 100![]() ; 3, 6 и 9 - 300
; 3, 6 и 9 - 300![]() . СKNO3, моль/л:
1 -3 – отсутствует; 4 – 6 – 5·10-3; 7 -9 -1·10-2.
. СKNO3, моль/л:
1 -3 – отсутствует; 4 – 6 – 5·10-3; 7 -9 -1·10-2.
Таблица 1.
Константы нестойкости катионов, образующихся по реакции (1),
как функция числа внутрисферных лигандов[2].
|
Константа нестойкости при величине К: |
||||
|
1 |
2 |
3 |
4 |
5 |
|
7·10-5 |
2,2·10-8 |
2,9·10-11 |
2,1·10-13 |
Отсутствуют |
Таким образом, в исследуемом случае в
растворе с исходным рН=7 присутствуют преимущественно катионы ![]() . Можно было полагать, что комплексные
аммиакаты меди
. Можно было полагать, что комплексные
аммиакаты меди ![]() сорбируются более эффективно, чем простые (Cu2+) и гидролизованные [
сорбируются более эффективно, чем простые (Cu2+) и гидролизованные [![]() катионы. Для проверки этого предположения
проведены исследования сорбционной способности того же концентрата глауконита
по отношению к катионам меди (II) в растворах, подщелачивание которых проводилось не
аммиаком, а гидроксидом калия, когда аммиакаты отсутствуют. Соответствующие
данные приведены на рис. 3.
катионы. Для проверки этого предположения
проведены исследования сорбционной способности того же концентрата глауконита
по отношению к катионам меди (II) в растворах, подщелачивание которых проводилось не
аммиаком, а гидроксидом калия, когда аммиакаты отсутствуют. Соответствующие
данные приведены на рис. 3.
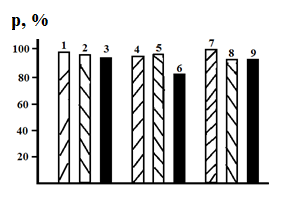
Рис. 3. Влияние температуры
термической обработки сорбента и добавки KNO3 на коэффициент ρ извлечения катионов Cu(II) концентратом
глауконита из раствора с исходным рН=7. 1, 4 и 7 – термическая обработка
сорбента отсутствует; 2, 5 и 8̶ - 100![]() ; 3, 6 и 9 - 300
; 3, 6 и 9 - 300![]() . СKNO3, моль/л:
1 - 3 – отсутствует; 4 - 6 – 5·10-3; 7 - 9̶ - 1·10-2.
. СKNO3, моль/л:
1 - 3 – отсутствует; 4 - 6 – 5·10-3; 7 - 9̶ - 1·10-2.
В
этом случае сорбционная способность концентрата даже несколько возрастает (рис.
2 и 3), достигая в ряде случаев величины ![]() = 99%. Этот
результат следует ожидать, если принять, что в роли внутрисферных лигандов
выступают молекулы воды, а катионы меди имеют вид: [Cu(H2O)3OH]+или
[Cu(H2O)4]2+.
Таким образом, как амины, так и
аквакомплексы меди, могут сорбироваться на глауконите за счет
донорно-акцепторной связи. Донорами электронных пар в первом случае выступают
атомы азота, а во втором – атомы кислорода. Степень гидролиза h катионов Cu(II) можно
рассчитать с использованием зависимости (2).
= 99%. Этот
результат следует ожидать, если принять, что в роли внутрисферных лигандов
выступают молекулы воды, а катионы меди имеют вид: [Cu(H2O)3OH]+или
[Cu(H2O)4]2+.
Таким образом, как амины, так и
аквакомплексы меди, могут сорбироваться на глауконите за счет
донорно-акцепторной связи. Донорами электронных пар в первом случае выступают
атомы азота, а во втором – атомы кислорода. Степень гидролиза h катионов Cu(II) можно
рассчитать с использованием зависимости (2).
![]() (2)
(2)
![]() – константа
диссоциации Cu(OH)2 по ступени (II),
равная 3,4∙10-7 [3].
– константа
диссоциации Cu(OH)2 по ступени (II),
равная 3,4∙10-7 [3].
В таблице 2 приведены подобные результаты.
Таблица 2.
Связь величины h c концентрацией ионов Cu2+ в растворе.
|
CCu2+, моль/л |
10-4 |
10-5 |
10-6 |
|
h, % |
1,8 |
5,7 |
18,2 |
Литература
1.
Яцимирский К.Б., Васильев В.П. Константы нестойкости комплексных соединений.
М.: Изд-во АН СССР. 1959. 207 с.
2.
Бьеррум Я. Образование аминов металлов в водном растворе. М: Изд-во иностр.
литературы. 1961. 308 с.
3. Алексеев В.Н. Количественный
анализ М.: Химия 1972. 504 с.