Медицина/морфология
К.б.н. Д.Е. Григоренко
ФГБУ НИИ морфологии человека РАМН,
Москва
Особенности
реакции лимфоидной (иммунной) ткани селезенки мышей после космического полета и
авиационного перелета
В
условиях космического полета на организм человека воздействуют различные
факторы внешней среды, наиболее значимыми из которых является невесомость и гравитация [1,2]. Известно, что влияние невесомости в
условиях космического полета приводит к перераспределению крови и изменению давления жидких сред в
организме, к снятию весовой нагрузки на опорные структуры и мышечную
систему и изменению нейроэндокринной
системы, тогда как гравитационные нагрузки в некоторой степени нивелируют эти
изменения [3, 4, 5]. Применение
сочетанного воздействия гипокинезии и гипергравитации также оказывает
профилактическое действие на состояние некоторых органов иммунной системы, в
частности, паховых лимфатических узлов у обезьян [6,7,8]. Для изучения влияния
отмеченных факторов на организм млекопитающих на космическом биоспутнике проведен эксперимент «БИОН-М1», целью которого
было исследование физиологического
состояния мышей и функционального состояния некоторых органов и тканей у мышей
[9]. Несмотря на многочисленные
биохимические и физиологические
исследования, менее всего изучены
морфологические изменения органов иммуногенеза у животного организма в условиях
космического полета. Вместе с тем
известно, что именно состояние иммунной системы характеризует и обеспечивает
стабильное функционирование организма при воздействии различных внешних
факторов [10]. Исходя из этого, целью нашего исследования являлось изучение особенностей
реакции иммунной (лимфоидной) ткани селезенки у мышей после авиационного
перелета и после 30-суточного космического
полета.
В
эксперименте приняли участие мыши-самцы C57 BL/6 в возрасте
19-20 недель. Изучены 3 группы животных.
Виварный контроль (6 особей) – интактные животные находились в обычных условиях
содержания. Базальный контроль (9
особей) - мыши осуществляли авиаперелет
на Байконур и обратно и содержались в боксах аналогичных в космическом полете
[9]. Полетная группа мышей (5 особей) –
находилась на борту биоспутника "БИОН-М1" в условиях невесомости в
течение 30 сут., где животных содержали
в блоках "БИОС-МЛЖ" [9]. Животные виварной группы получали
стандартный гранулированный комбикорм и воду в свободном доступе. Полетные животные и мыши базального
контроля получали пастообразный корм,
изготовленный из стандартного комбикорма, воды и казеина (в качестве
загустителя), содержание воды в котором
составляло 76-78% [9]. После
окончания экспериментов животные всех групп были забиты методом цервикальной
дислокации. Селезенки мышей фиксировали в 10% растворе нейтрального формалина, заливали в
парафин. Гистологические срезы, толщиной 4-5 мкм, окрашивали азур2-эозином,
гематоксилином-эозином и по ван Гизон. В селезенке исследовали
цитоархитектонику центров размножения лимфоидных узелков, являющихся зоной созревания В-лимфоцитов и характеризующих
состояние гуморального иммунитета, а также клеточный состав периартериальных лимфоидных муфт (ПАЛМ)
- морфологической зоны созревания и
накопления Т-лимфоцитов, определяющих состояние клеточного иммунитета в организме
животных [10,11]. Изучен качественный
и количественный клеточный состав
лимфоидных структур селезенки на единице площади гистологического среза (в 880мкм²). Подсчет всех клеток в
лимфоидных зонах селезенки проводили
под микроскопом Leica при увеличении объектива –
х100, под масляной иммерсией.
Использовали 25-узловую морфометрическую сетку с шагом 10 мкм,
вмонтированную в окуляр (10х) микроскопа. Анализ абсолютного и относительного
(в %) числа клеток в структурных зонах органа проводили на
единице площади гистологического среза (880 мкм2). Статистическая
обработка результатов проведена по программе «Statistika 6.0» и Excel. Значимыми
считали различия при р≤0,05.
У интактных мышей (виварный контроль) в селезенке
лимфоидные образования представлены, в основном, лимфоидными
узелками без центра размножения, лимфоидные узелки с центрами размножения -
немногочисленны. Центры размножения в лимфоидных узелках небольшие, слабо выражены. Плотность распределения клеток в центрах
размножения лимфоидных узелков составляет 45,07±4,18 клетки на единице площади
гистологического среза. Основную долю всех клеток в центрах размножения
составляют средние лимфоциты (25,27±1,93%). Малодифференцированные клетки
представлены бластами и большими лимфоцитами, на долю которых приходится 12,98%
(2,82%-бласты и 10,16%-большие лимфоциты, рис.1). Выявлены клетки с картинами
митозов (0,93±032%), зрелые
(антителпродуцирующие) плазматические клетки (2,04±0,42%) и незрелые
плазматические клетки (плазмобласты -0,97±0,43%). Малых лимфоцитов в 1,8 раз
меньше, чем средних лимфоцитов. В центрах размножения лимфоидных узелков выявлена
значительная доля деструктивно
измененных клеток (18,75%). Содержание макрофагальных клеток в 3,7 раза меньше,
чем деструктивных клеток.
В селезенке мышей интактной группы периартериальные лимфоидные
муфты (ПАЛМ) широкие, четко дифференцируются. Плотность распределения клеток в
них составляет 56,73±3,08 клетки на стандартной площади среза. ПАЛМ на
61,0%состоят из малых и средних лимфоцитов (46,37±2,77% и 14,63±1,61%,
соответственно). Выявлены клетки в состоянии деструкции (13,67%, рис.2). В ПАЛМ из общего числа
малодифференцированных клеток бласты
составляют 0,11%, большие лимфоциты -2,71% (рис.1). Плазматические клетки
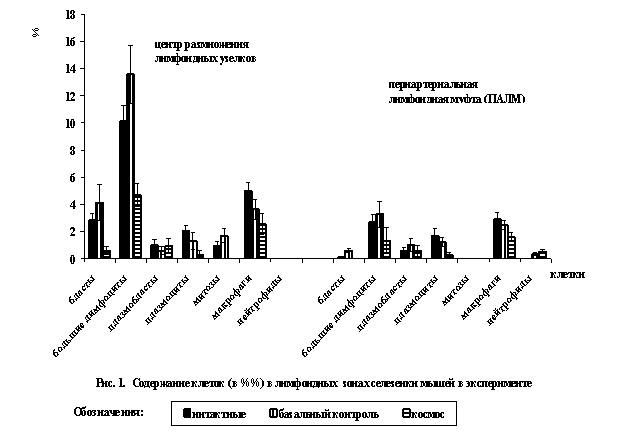
представлены незрелыми плазмобластами
(0,58%) и зрелыми (антителпродуцирующими)
плазмоцитами (1,68%). На долю макрофагов приходится всего 2,90%. Клетки
с картинами митозов отсутствуют.
Базальный контроль (перелет мышей на Байконур и
обратно) можно рассматривать как стрессовую ситуацию на организм животных без воздействия
космических сил (гипергравитации и невесомости). В этих условиях в селезенке мышей отмечаются крупные лимфоидные
узелки с более широкими центрами размножения, чем в виварном контроле. В
базальном контроле в центрах размножения лимфоидных узелков плотность
распределения лимфоидных клеток больше, чем в виварном контроле на 20,4 клетки на единице площади среза. Основную
долю клеток составляют средние
лимфоциты (33,12%) и стромальные
ретикулярные клетки (20,76%). Значительная
часть клеток приходится на малодифференцированные клетки (17,71%), среди
которых содержание бластов (4,14%) в 1,5 раза больше, чем в виварной группе
животных (рис.1). Содержание больших лимфоцитов практически одинаково в обеих
группах (в виварном контроле - 10,61% и в базальном контроле -13,57 %, различия
не достоверны). В базальном контроле в
поле зрения на гистологическом срезе в
центрах размножения узелков встречается 3-4 клетки в
состоянии митоза, которых в 1, 8 раза
больше, чем в виварном контроле (рис.1).
В центрах размножения лимфоидных
узелков среди плазматических клеток вдвое преобладают зрелые (антителпродуцирующие)
клетки – 0,60% плазмобластов и 1,31%- плазмоцитов, общее содержание которых в
1,5 раза больше, чем в виварной группе. Клетки в состоянии деструкции в
базальном контроле встречаются в 1,6 раза реже, чем в виварном контроле (11,83%
и 18,75%, соответственно, рис.2) и в 1, 4 раза меньше выявлено макрофагов.

В периартериальных лимфоидных муфтах (ПАЛМ) селезенки
мышей в базальном контроле плотность распределения клеток на стандартной
площади среза достоверно не отличается от показателей в виварной группе (11,64
клетки и 13,67 клетки, соответственно). Также выявлено практически равное
содержание лимфоцитов (64,12%- в базальном контроле и 61,0% - в виварном
контроле) и деструктивно измененных клеток (рис.2), а также общего числа плазматических
клеток (2,24% и 2,26%) и макрофагов. Вместе с тем в ПАЛМ в базальном контроле, по сравнению с
виварной группой, в 5 раз чаще
встречаются бласты (0,59% и 0,11%) и появляются нейтрофилы (0,35%), которые не
выявлены в виварном контроле.
Исследование результатов базального контроля показало, что, по сравнению с виварным контролем, авиаперелет на
Байконур и обратно, приводит к выраженным изменениям в клеточной структуре
центров размножения лимфоидных узелков и в ПАЛМ в селезенке мышей. Выявлено уменьшение деструкции клеток и резкое
усиление лимфоцитопоэза в изучаемых морфофункциональных зонах селезенки (увеличение содержания
малодифференцированных клеток и клеток с картинами митозов, особенно, в центрах
размножения лимфоидных узелков). Установлено, что в селезенке в результате
авиаперелета (базальный контроль) в морфологических зонах созревания и формирования В-клеток и в зоне накопления Т-лимфоцитов,
отмечается усиление процессов, регулирующих гуморальный и клеточный иммунитет в
организме животных [5,10,11].
После 30 суточного космического полета, по сравнению с базальным
контролем, в центрах размножения лимфоидных узелков селезенки мышей исчезают
клетки с картинами митозов, число
бластов уменьшается в 6,9 раза (от
4,14% до 0,60%), больших лимфоцитов - в 2,9 раза (от 13,57% до 4,68%, рис.1).
При этом меняется соотношение плазматических клеток (рис.1) - в 1,5 раза увеличивается доля плазмобластов,
но резко снижается число зрелых (антителпродуцирующих) плазматических клеток в
4,2 раза (от 1,31% до 0,31%). После космического полета в центрах размножения
лимфоидных узелков происходит усиление деструкции клеток (рис.
2), при которой число деструктивно измененных клеток увеличивается в 1,7
раза (от 11,83% до 20,77%) при снижении макрофагальной реакции в 1,4 раза.
В ПАЛМ после космического полета резко уменьшается
число малых лимфоцитов (на 10,05%, рис
2.) Среди малодифференцированных клеток исчезают бласты, а число больших лимфоцитов
снижено в 2,4 раза (рис. 1). Как и в центрах размножения лимфоидных узелков, в
ПАЛМ резко уменьшается общее число плазматических клеток (в 2,6 раза) и,
особенно, зрелых плазматических клеток
(плазмоцитов) – в 4,2 раза. На фоне значительного (в 2,2 раза) увеличения
числа деструктивно измененных клеток
(от 11,64% до 25,57%) снижена макрофагальная активность клеток - число макрофагов
уменьшается в 1,5 раза. При этом отмечено увеличение содержания нейтрофилов, особенно, их незрелых форм - в
2,3 раза, что в условиях дефицита макрофагов является, видимо, компенсаторной реакцией в организме [2,10].
В результате исследования установлено, что у
мышей после космического полета, по сравнению с базальным контролем, происходят резкие нарушения в цитоархитектонике лимфоидной
ткани селезенки, которые могут приводить к развитию иммунодефицитного состояния
[2,10]. Выявленное в лимфоидных зонах
селезенки (в центрах размножения лимфоидных узелков и в ПАЛМ) полное подавление митотической активности клеток на фоне
уменьшения бласттрансформации клеток характеризует резкое подавление процессов лимфоцитопоэза
в органе [5,11]. Перестройка в соотношении плазматических клеток, как в центрах
размножения лимфоидных узелков, так и в
ПАЛМ, в сторону уменьшения их
зрелых антителпродуцирующих форм
(плазмоцитов - в 4,2 раза)
свидетельствует о снижении уровня иммуноцитопоэза после космического полета [5,
10]. Вместе с тем, более выраженная деструкция клеток отмечается
в ПАЛМ, чем в центрах размножения лимфоидных узелков, при сравнительно равном
снижении макрофагальной активности в
изучаемых структурах селезенки, что
связано, возможно, с угнетением зоны Т-лимфоцитов в селезенке мышей в условиях
космического полета. Таким образом, можно сделать вывод, что после 30-суточного
полета, по сравнению с базальным контролем, в изучаемых иммунных структурах
селезенки наступают столь резкие изменения в кооперации клеток, которые
характеризуют резкое снижение
лимфоцитопоэза и иммуноцитопоэза на
фоне усиления деструкции клеток, что приводит к нарушению гуморального и клеточного
иммунитета в организме животных [10,11].
Список литературы
1. Григорьев А.И. Животные в космосе /Григорьев А.И.,
Ильин Е.А.// Вест. Рос. Академии наук. М., 2007. т.77.- №11.- С. 963-973.
2. Константинова И.В. Система иммунитета в
экстремальных условиях. Проблемы космической биологии / Константинова И.В.- М.:
Наука, 1989. Т. 59, 288 с.
3. Козловская
И.Б. Механизмы влияния невесомости на системы управления жизнеобеспечения
организма / Козловская И.Б. //В кн.:
Тез. докладов Междунар. конф. по
физиологии мышечной деятельности. М.: Изд-во СИП РИА, 2002. с. 10-15.
4. Ларина И.М.
Космический полет и регуляция метаболизма у человека /Ларина И.М - М.: Наука,
2004. с. 13-16.
5. GridleyD.S.
Changes in Mouse Thymus and Spleen after Return from the STS-135 Mission in Space
/ GridleyD.S., Mao X.W.,Stodieck L.S. et al. //PLOS ONE, 2013. v.8.- №9.- p. e75097.
6. Григоренко Д.Е. Длительное воздействие
гипокинезии на структурную организацию паховых лимфатических узлов обезья / Григоренко
Д.Е., Ерофеева Л.М, Корольков В.И., М.Р. Сапин М.Р.// Вестник
новых мед. технологий.- 2005. т.12.- №1.- с. 19-21.
7. Григоренко
Д.Е. Эффект воздействия гипергравитации на структурно-функциональную
организацию лимфоидной ткани селезенки / Григоренко Д.Е., Краснов И.Б., Сапин
М.Р. // Морфология. 2003.- т. 123.- № 3. с. 60-64.
8.Alexeev E.L. Pancreatic cell responses to primary
and repeated 2G influence / Alexeev
E.L., Krasnov I.B. //J. Gravit. Physiol.
2002.- v. 9. №
1.- p. 303-304.
9. Андреев – Андриевский А.А., Шенкман Б.С., Попова А.С.,
Долгов О.Н. и др. Экспериментальные исследования на мышах по программе полета
биоспутника "Бион-М1"/ Андреев – Андриевский А.А., Шенкман Б.С., Попова
А.С., Долгов О.Н. и др.// Авиакосмическая и экологическая медицина. 2014.- т.48.- №1.
с.14-27.
10. Сапин М.Р. Иммунная система, стресс и иммунодефицит / Сапин М.Р.,
Никитюк Д.Б. М.: АПП «Джангар». 2000.-
184 с.
11. Gray D. Understanding germinal centre /Gray D. //Res. Immunol. 1991.- v. 142.- p.
236-242.