Химия и химические технологии/
6.Органическая химия.
К.х.н. 1 Валюк В.Ф., к.х.н. 2 Шилін С.В.
1Уманський
державний педагогічний університет
ім. Павла Тичини, природничо-географічний факультет, кафедра агробіотехнологій та хімії,
02003, Україна, Умань, вул. Садова 2, e-mail: Vvalyuk@mail.ru
2 Київський
національний університет імені Тараса Шевченка, хімічний факультет, кафедра
органічної хімії. 01033 Україна, Київ, вул. Володимирська, 64.
Синтез амінокислотних похідних кумарину
за реакцією
Манніха
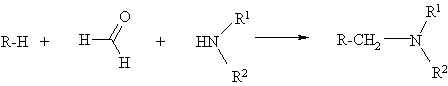
Амінометилювання за
Манніхом полягає у конденсації субстрату (R-H), що містить принаймі один
активний атом водню, з формальдегідом (зрідка з іншими альдегідами) та
первинними чи вторинними амінами (схема 1) [1-2].
Схема 1
Ця реакція є одним з
методів хімічної модифікації, в результаті якої в молекулу гетероциклу вводять
функцію основи, що робить сполуку розчинною у водному середовищі. Важливим
також є те, що амінометильованим похідним кумарину притаманні різноманітні види
біологічної активності. Наприклад, вони є стимуляторами діяльності центральної
нервової системи і антагоністами барбітуратів [2], антиоксидантами,
протизапальними агентами, а також інгібіторами ліпоксигенази [3]. Саме реакція
Манніха була покладена нами в основу першого підходу для одержання
амінокислотних похідних кумарину. Раніше було показано, що амінометилювання за
Манніхом 5- і 6-гідроксикумаринів іде незадовільно, тоді як 7-гідроксикумарини
легко вступають в цю реакцію [4-5].
Нижче наведено синтез амінометильованих
похідних бензопірону на основі 7-гідроксикумаринів 2.1.1, 2.1.3, 2.1.5, 2.1.7,
2.1.9, 2.1.11, 2.1.13 та 2.1.15. Реакцію С-амінометилювання
здійснювали тривалим нагріванням суміші зазначених 7-гідроксикумаринів, відповідної
амінокислоти та еквівалентної кількості формаліну у водно-спиртовому розчині
(схеми 2-3) [4-5]. Відомо, що у кумаринів орто-положення до гідроксилу є
найкращим для атаки в умовах реакції Манніха і що амінометилювання
7-гідроксикумаринів, які не містять замісників у положенні 8, проходить
виключно у вказане положення гетероциклічної системи. Це пояснюється
особливостями механізму реакції, згідно з яким спочатку утворюється водневий
зв’язок між реагентом Манніха та субстратом, і лише після цього відбувається
атака в орто-положення гетероциклу [6]. Проведені дослідження показали,
що в зазначену реакцію успішно вступають різні амінокислоти: аланін,
2-амінобутанова кислота, валін, норвалін, лейцин, ізолейцин, норлейцин та
фенілаланін, і це призводить до утворення
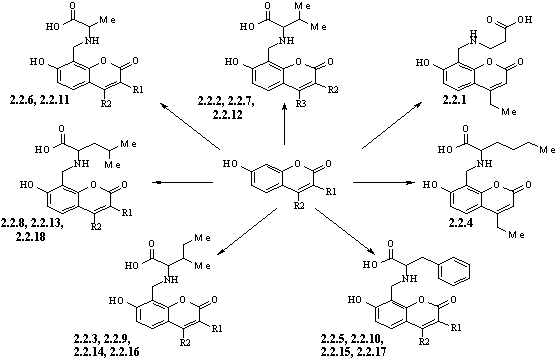
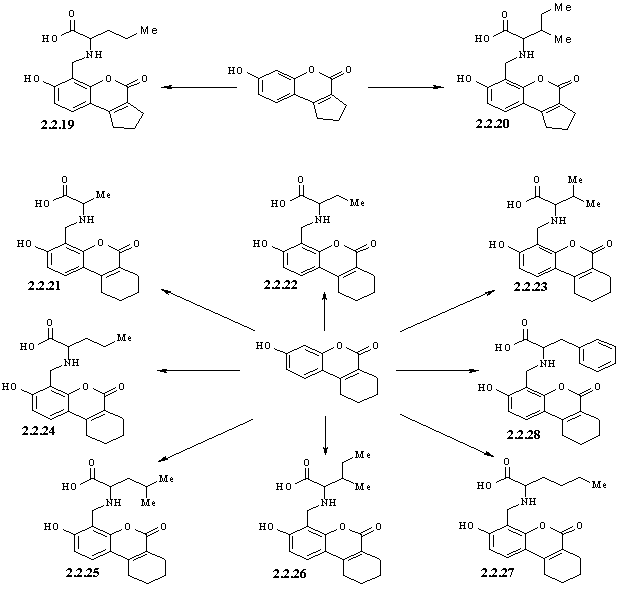
7-гідрокси-8-(N-аміноацил)метилкумаринів 2.2.1-2.2.27.
Схема 2.
2.2.2, 2.2.3, 2.2.5. R1=H, R2=CH2CH3; 2.2.6-2.2.10.
R1=H, R2=(CH2)2CH3; 2.2.11-2.2.14. R1=H,
R2=(CH2)3CH3; 2.2.15. R1=R2=CH3;
2.2.16, 2.2.17. R1=(CH2)5CH3, R2=CH3;
2.2.18. R1=CH2C6H5, R2=CH3;
Схема 3.
Будову одержаних основ Манніха було підтверджено
спектрами ПМР та даними кількісного елементного аналізу. У спектрах ЯМР-1Н
цих похідних, які були записані у трифтороцтовій кислоті, спостерігається
спрощення спектру в області ароматичних протонів кумарину. Зокрема відсутні
сигнали в області 6,7-6,8 м.ч. протона Н-8 кумаринової системи. Ароматичні
протони у положеннях 5 і 6 резонують у вигляді дублетів з КССВ 8 Гц в області
6,8-8,0 м.ч. В спектрах ПМР одержаних основ Манніха 2.2.1-2.2.27 спостерігаються також двопротонні сигнали метиленової
групи амінокислотних залишків в області 4,9-5,0 м.ч. (рис. 5). В ІЧ-спектрах основ
Манніха присутня дуже інтенсивна смуга коливань СО-груп біля 1700 см-1.
Література:
1.
Ф.Блик. О реакции Манниха. In:
Органические реакции сб. 1, Издатинлит, 1948. – С. 399-401.
2.
Ачибабян А.Г., Геворгян
Г.А., Мнджоян О.А. Аминокислоты в качестве аминного компонента в реакции
Манниха. // Успехи химии. – 1982. – Т. 51, № 4. – С. 678-695.
3.
Kontogiorgis C.A., Hadjipavlou-LitinaD.J. Synthesis and antiinflammory activity of coumarin derivatives. // J.
Med. Chem. –2005.-Vol. 48, № 20. – P. 6400-6408.
4.
Desai R.B. Mannich
reaction with hydroxycoumarins. // J. Org. Chem. – 1961. – Vol. 26, № 12. – P.
5251-5253.
5.
Da Re P., Bonola G., Verlicchi L. A series of coumarin derivatives with central stimulating activity. //
J. Med. Chem. – 1964. – Vol. 7, № 2. – P. 162-166.
6.
Tramontini V. Advances in chemistry of Mannich bases. //
Synthesis. – 1973. -№ 12. – P. 703-775.