ИССЛЕДОВАНИЕ
ВОЗМОЖНОСТИ СОКРАЩЕНИЯ ОБЪЕМОВ СБРАСЫВАЕМЫХ СТОЧНЫХ ВОД НА СТАНЦИЯХ
ВОДОПОДГОТОВКИ ТЭЦ.
Рабочим
телом паротурбинных электростанций является пар, соответственно подготовка воды
с целью получения пара – это неотъемлемая часть технологии выработки
электроэнергии.
Одним из
наиболее распространенных и практически повсеместно применяемым методом
подготовки котловой воды является метод ионного обмена. Он позволяет получить
воду в необходимом объеме с солесодержанием до 0,001 мг/л.
Недостатком
метода является образование большого количества сильноминерализованных сточных
вод.
Обмен
катионов природной воды при катионировании
на ионы Н+ содержащиеся в катионите, протекает по реакциям:
2Н[Кат] + Са++ → Са[Кат]2
+ 2 Н+
2Н[Кат] + Mg++
→ Mg[Кат]2 + 2 Н+
Известно,
что применяемые на водоподготовке ионообменные материалы проявляют
селективность к названным ионам, возрастающую в сорбционном ряду Са++ > Mg++ > Nа+ [1]. Поэтому кроме реакции обмена на ион
водорода протекают реакции
взаимного вытеснения катионов. Хуже сорбируемые ионы натрия вытесняются из
катионита лучше сорбируемыми ионами кальция и магния.
В
динамических условиях, вероятно образование трех зон поглощения. Естественно
предположить, что при регенерации вышеуказанные катионы будут удаляться из
фильтра по той же закономерности, только в обратной последовательности. Тогда,
объем регенерационного раствора можно было бы разделить на три части и решать
вопрос утилизации каждой отдельно. Изучение возможности реализации данной идеи
является целью предложенной работы.
Исследования проводились в промышленных условиях на прямоточном Н -
катионитном фильтре, загруженном карбоксильным катионитом марки Lewatit CNP – 80
фирмы Байер. Полная обменная емкость 4,2 г-экв/л.
Объем воды, обработанной за фильтроцикл фильтра, 4500
м3. Процесс «регенерация-отмывка» производился в динамическом режиме
раствором серной кислоты по двухступенчатой схеме со скоростью 20 м/ч,
продолжительностью 90 мин.
Химизм
реакций регенерации:
Са[Кат]2 + Н2SO4 → 2Н[Кат]
+ Са SO4
Mg[Кат]2 + Н2SO4 → 2Н[Кат]
+ Mg SO4
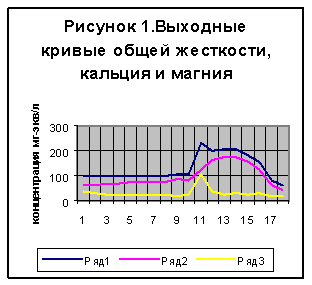
Регенерация описывается кривыми,
представленными на рисунке 1.
Ход кривых показывает, что ожидаемого резкого
разделения катионов не происходит. Мы условно разделили образуемый регенерационный
раствор на три порции
Но первая порция отработанного регенерационного
раствора характеризуется общей жесткостью от 53 мг-э/л до 98 мг-э/л,
содержанием кальция от 28 мг-э/л до 60 мг-э/л.
Во второй
порции результат показателей общая жесткость
возрастает от 98 мг-э/л до 209 мг-э/л затем постепенно снижается до 80 мг-э/л,
содержанием кальция соответственно от
60 мг-э/л до 178 мг-э/л, снижается до 64 мг-э/л.
Таким
образом, весь объем сточных вод процесса регенерация-отмывка целесообразно
разделить на две части, первую в течении 20 мин и последнюю спустя 90 мин,
содержание кальция и магния в которых практически равное. Вторую часть, где
преобладает сульфат кальция, целесообразно собрать.
Сульфат
кальция, с течением времени самоосождается. Его можно использовать как сырье
для приготовления гипса. По
предварительно проведенным расчетам количество СаSO4 от
регенерации одного фильтра, составит 0,7 тонны.
Литература
1. Водоподготовка. Процессы и аппараты. Под редакцией
д.т.н. проф.
О.И. Мартыновой. Учебное пособие для ВУЗов. М.:
Атомиздат, 1977.
2. Белан Ф.И., Сутоцкий Г.П. Водоподготовка
промышленных кательных.М.: «Энергия»,
1969.
3. Вихрев В.Ф., Шкроб М.С. Водоподготовка. М.:
«Энергия» 1973.