Береснев
А.И., Квач С.В., Зинченко А.И.
Институт
микробиологии НАН Беларуси, Минск
ОПТИМИЗАЦИЯ КОНЦЕНТРАЦИИ ИНДУКТОРА ДЛЯ НАРАБОТКИ
РЕКОМБИНАНТНЫХ НУКЛЕОЗИДФОСФОРИЛАЗ
Введение. Для создания рекомбинантных штаммов Escherichia coli, широко используется экспрессионная pET-система. Встроенный в pET-плазмиду ген, кодирующий целевой белок, находится под контролем сильного T7-промотора, обеспечивающего суперпродукцию мРНК этого гена [[1]]. Индукция экспрессии встроенного в плазмиду гена бактериальными клетками рекомбинантного штамма происходит после внесения в среду культивирования изопропил-β-D-тиогалактопиранозида (ИПТГ). Как правило, конечная концентрация ИПТГ в культуральных жидкостях (КЖ) после его внесения находится в диапазоне значений от 0,5 до 1 мМ [[2], [3]]. С учетом того, что стоимость ИПТГ является относительно высокой, целесообразно подбирать такое его вносимое минимальное количество, при котором будет наблюдаться достаточный уровень синтеза целевого белка клетками бактерий.
Нуклеозидфосфорилазы являются наиболее широко распространенными ферментами, применяющимися для биотехнологического получения природных и модифицированных нуклеозидов. В одной из наших недавних работ была показана возможность использования пиримидиннуклеозидфосфорилазы, кодирующейся мутантным геном mutdeoA (мутПирНФазы) Thermus thermophilus и пуриннуклеозидфосфорилазы (ПурНФазы) E. coli для ферментативного синтеза ряда фторированных нуклеозидов [[4]].
Таким образом, целью настоящей работы явилось изучение влияния количества вносимого в среду культивирования ИПТГ на конечный выход синтезируемых мутПирНФазы и ПурНФазы.
Объекты и методы исследования. В работе использовали сконструированные нами ранее рекомбинантные штаммы E. coli КНК–12/5 и БМ–Д6, продуцирующие мутПирНФазу T. thermophilus и ПурНФазу E. coli, соответственно.
Бактериальные клетки штаммов-продуцентов культивировали в колбах Эрленмейера, содержащих 0,5 л солевой питательной среды (1 % триптон, 0,5 % дрожжевой экстракт, 0,05 М Na2HPO4, 0,05 М KH2PO4, 0,025 М (NH4)2SO4, 0,75 % (w/v) глицерин, 0,075% глюкоза, 2 мМ MgCl2, 50 мкг/мл канамицина) на шейкере (240‒250 об/мин) при 37оС. Клетки E. coli выращивали до достижения КЖ оптической плотности 0,6 при λ=600 нм, затем осуществляли индукцию синтеза целевого белка путем внесения ИПТГ до конечной концентрации 0,05–1,0 мМ и продолжали культивирование в течение 4–5 ч.
 Результаты и обсуждение. Из данных, полученных в
ходе анализа электрофореграммы (рис. 1), следует, что количество синтезируемой
бактериальными клетками мутПирНФазы при минимальной концентрации ИПТГ (0,05 мМ)
меньше такового при индукции 1 мМ ИПТГ на 10±3 %, в то время, как количество наработанной
мутПирНФазы при индукции с 0,1 мМ ИПТГ меньше лишь на 3±1 %.
Результаты и обсуждение. Из данных, полученных в
ходе анализа электрофореграммы (рис. 1), следует, что количество синтезируемой
бактериальными клетками мутПирНФазы при минимальной концентрации ИПТГ (0,05 мМ)
меньше такового при индукции 1 мМ ИПТГ на 10±3 %, в то время, как количество наработанной
мутПирНФазы при индукции с 0,1 мМ ИПТГ меньше лишь на 3±1 %.
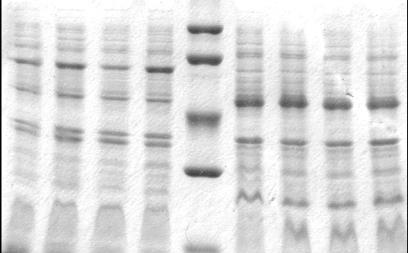
Данные, полученные после анализа электрофореграммы, подтверждены измерением ферментативных активностей. Таким образом, показано, что наибольшее количество целевого фермента синтезируется бактериальными клетками спустя 4 ч после начала индукции ИПТГ в концентрации 0,1–1 мМ.
Подобные эксперименты были проведены для рекомбинантного штамма E. coli БМ–Д6. Полученные результаты представлены на рис. 2.

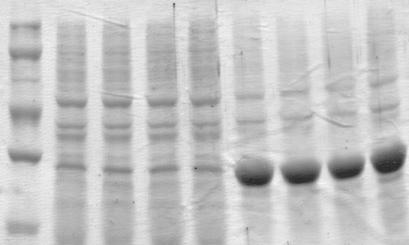
Как и в случае с мутПирНФазой, различия в количестве синтезированной ПурНФазы в клетках бактерий при внесении минимально и максимально взятых количеств ИПТГ незначительны. В результате измерения ферментативных активностей наработанных ферментов показано, что наибольшая продуцирующая способность бактериальных клеток штамма E. coli БМ–Д6 достигается после 4 ч индукции с концентрацией ИПТГ 0,1–1 мМ.
Таким образом, 0,1 мМ ИПТГ может быть использован для достижения такого же уровня индукции синтеза нуклеозидфосфорилаз клетками бактерий генно-инженерных штаммов E. coli, как и при наиболее часто указываемых в литературе концентрациях ИПТГ (0,5–1 мМ).
Литература: