Биологические науки/6
Микробиология
д.т.н. Бабич О.О.
ФГБОУ ВПО «КемТИПП»
д.т.н. Просеков А.Ю.
ФГБОУ ВПО «КемТИПП»
аспирант Зимина М.И.
ФГБОУ ВПО «КемТИПП»
к.т.н. Сухих С.А.
ФГБОУ ВПО «КемТИПП»
Изучение антиоксидантных, гепатопротекторных и
противоопухолевых свойств микроорганизмов желудочно-кишечного тракта
Желудочно-кишечный тракт представляет
собой одну из наиболее сложных микроэкологических сред организма человека, в
которой на суммарной площади слизистой оболочки, составляющей около 400 м,
имеется исключительно высокая и разнообразная (свыше 500 видов) плотность
микробной обсеменённости, в которой очень тонко сбалансировано взаимодействие
между защитными системами организма и микробными ассоциациями. Бактерии
составляют от 35 до 50% объёма содержимого ободочной кишки человека, а их совокупная
биомасса в желудочно-кишечном тракте приближается к 1,5 кг [1].
Желудочно-кишечный тракт – это комплексная
экосистема, которая представлена ассоциацией резидентной микробиоты и клетками
различных фенотипических линий эпителиальной стенки. Термин микробиота,
предложенный Savage D.С., представляет собой коллективное сообщество бактерий
на слизистых оболочках каждого индивидума. Взаимно дополняя друг друга,
организм и сопровождающие его бактерии образуют единую симбиотическую систему.
При этом организм представляет не только среду обитания, находясь в состоянии
динамического равновесия с собственной микрофлорой, но и является частью этой
системы [2].
Млекопитающие изначально рождаются
стерильными. Колонизация гастроинтестинального тракта начинается сразу же после
рождения. Первые бактерии, колонизирующие кишечник, попадают из родовых путей и
включают аэробные и анаэробные бактерии, такие как Escherichia coli, Clostridium spp., Streptococcus spp., Lactobacillus spp., Bacteroides spp. и Bifidobacterium spp.[3].
Резидентная микрофлора пищеварительного
тракта – это гетерогенная микробная экосистема, которая содержит до 1·1014
КОЕ бактерий. Микробиота на протяжении всего желудочно-кишечного тракта
отличается по видовым и количественным характеристикам, заселяет различные
биотопы человеческого организма, включающие в себя полости рта, носа, глотки,
кожу, кишечный и вагинальный тракты. Желудок из-за низкого рН является плохо
колонизируемым органом, микрофлора которого включает в себя в основном
лактобациллы, стрептококки и дрожжевые грибы в количестве 103 КОЕ на
грамм содержимого (КОЕ/г). Helicobacter pylori в желудке
встречается только в определённых географических регионах мира.
Двенадцатиперстная кишка или начальный отдел тонкого кишечника также имеет
низкую популяцию микроорганизмов из-за быстрого транзита содержимого через неё,
а также благодаря панкреатическому секрету, создающему для микробов неблагоприятную
среду [5]. По ходу тонкого и тощего кишечника наблюдается значительное
увеличение видового и количественного состава микрофлоры, который в среднем
составляет 104-106-7 КОЕ/г в области илеоцекального угла.
Основными механизмами, препятствующими их росту в тонкой кишке, являются
антибактериальное действие желчи; кишечная перистальтика, обеспечивающая
быстрый пассаж микроорганизмов в дистальный отдел кишечника, выделение в
просвет кишки из её стенки иммуноглобулинов; ферментативная активность нормофлоры;
состояние кишечного эпителия и слизи, выделяемой бокаловидными клетками
кишечника, содержащей ингибиторы роста микроорганизмов. При нарушении указанных
механизмов нарастает микробное обсеменение тонкой кишки [2, 4].
Важным свойством
пробиотических штаммов, выделенных из желудочно-кишечного тракта человека, в
связи с их использованием в технологии создания функциональных продуктов
питания для реабилитации онкологических больных, является антиоксидантная
активность [5]. Антиоксидантную активность выбранных штаммов измеряли в
соответствии с методикой, описанной Cao et al. (1995), основанной на ингибировании радикального
окисления β-фикоэритрина. Результаты измерения антиоксидантной активности
пробиотических штаммов представлены на рисунке 1.
Из рисунка 1 следует, что
наибольшей антиоксидантной активностью характеризуются бесклеточные экстракты
штаммов Lactobacillus fermentum (тролокс-эквивалент на 109 клеток равен 2182), Micrococcus spp. (тролокс-эквивалент на 109 клеток равен 1968) и Lactobacillus plantarum (тролокс-эквивалент на 109
клеток равен 1914).
В то же время максимальная антиоксидантная
активность интактных клеток наблюдается у штаммов Bifidobacterium breve (тролокс-эквивалент на 109
клеток равен 896), Lactobacillus salivarius (тролокс-эквивалент
на 109 клеток равен 822), Lactobacillus plantarum (тролокс-эквивалент на 109
клеток равен 725).
Максимальная величина тролокс-эквивалента
бесклеточных экстрактов к тролокс-эквиваленту интактных клеток характерна для штаммов Lactobacillus fermentum (3,8), Micrococcus spp. (3,2) и Lactobacillus
plantarum (2,6), а минимальная – для штаммов Bifidobacterium breve (1,2), Lactobacillus acidophilus (1,2) и Bifidobacterium
bifidum (1,5).
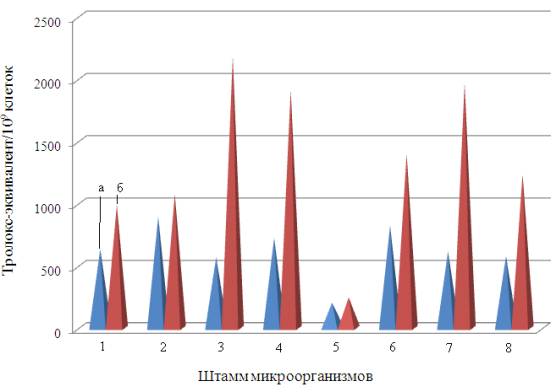
Рисунок 1 – Результаты определения
антиоксидантной активности пробиотических штаммов, выделенных из
желудочно-кишечного тракта человека: 1 – Bifidobacterium
bifidum; 2 – Bifidobacterium
breve; 3 – Lactobacillus
fermentum; 4 – Lactobacillus
plantarum; 5 – Lactobacillus
acidophilus; 6 – Lactobacillus
salivarius; 7 – Micrococcus spp.; 8 – Streptococcus agalactiae; а – интактные клетки; б – бесклеточный эктракт
Гепатопротекторные свойства штаммов,
выделенных из желудочно-кишечного тракта человека, изучали, наблюдая
ингибирующий эффект микроорганизмов на продуцирование β-глюкуронидазы
штаммом E. coli
HGU-3. Тест-штамм E. coli
HGU-3 является продуцентом β-глюкуронидазы в
желудочно-кишечном тракте человека. Основные патологические состояния, при
которых отмечается повышение сывороточной β-глюкуронидазы, – это заболевания
печени, особенно злокачественные опухоли. В ходе эксперимента проводили
анаэробное культивирование выбранных штаммов с E. coli
HGU-3 и измеряли ингибирующую активность рассматриваемых
штаммов по отношению к продуцированию β-глюкуронидазы E. coli HGU-3.
Полученные результаты представлены на рисунке 4.2.2.
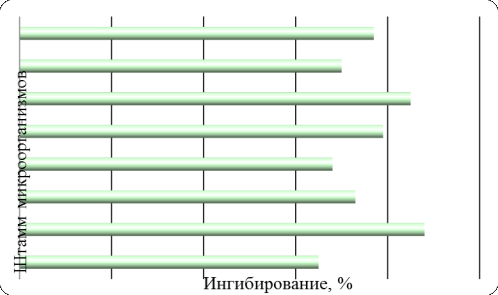
Рисунок 2 – Ингибирующий эффект штаммов, выделенных из
желудочно-кишечного тракта человека, на продуцирование β-глюкуронидазы E. coli HGU-3: 1 – Bifidobacterium
bifidum; 2 – Bifidobacterium
breve; 3 – Lactobacillus
fermentum; 4 – Lactobacillus
plantarum; 5 – Lactobacillus
acidophilus; 6 – Lactobacillus
salivarius; 7 – Micrococcus spp.; 8 – Streptococcus agalactiae.
Из рисунка 2 видно, что все исследуемые штаммы ингибируют продуцирование β-глюкуронидазы E. coli HGU-3 от 65% (Bifidobacterium
bifidum) до 88% (Bifidobacterium breve). Максимальной ингибирующей способностью характеризуются штаммы Bifidobacterium breve (88%), Lactobacillus salivarius (85%) и Lactobacillus
acidophilus (79%).
Полученные данные свидетельствуют о
выраженных гепатопротекторных свойствах штаммов, выделенных из
желудочно-кишечного тракта человека.
Для изучения антипролиферативной
активности штаммов, выделенных из желудочно-кишечного тракта человека,
проводили МТТ-тест на различных раковых клеточных линиях: лимфомы Беркитта ЛБР2,
рака предстательной железы человека DU 145, рака молочной железы человека
MDAMB-231 и MCF7, гепатоцеллюлярной карциномы HepG2, рака головного мозга U-87, рака поджелудочной железы человека PANC-1. Результаты определения противоопухолевой
активности изучаемых штаммов приведены в таблице 1
Таблица 1 – Результаты определения
противоопухолевых свойств штаммов, выделенных из желудочно-кишечного тракта
человека
|
Выживаемость клеток, %, при разной
концентрации микроорганизмов, КОЕ/мл |
Клеточная линия |
||||||
|
ЛБР2 |
DU 145 |
MDAMB-231 |
MCF7 |
HepG2 |
U-87 |
PANC-1 |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Bifidobacterium bifidum |
|||||||
|
105 |
86,3±1,2 |
90,8±1,3 |
77,5±1,1 |
92,6±1,3 |
112,2±1,6 |
95,0±1,3 |
84,3±1,2 |
|
107 |
45,9±0,6 |
52,1±0,7 |
38,7±0,5 |
46,1±0,6 |
57,0±0,8 |
53,8±0,8 |
37,2±0,5 |
|
Bifidobacterium breve |
|||||||
|
105 |
62,3±0,9 |
73,4±1,0 |
54,3±0,8 |
65,0±0,9 |
62,9±0,9 |
70,5±1,0 |
58,9±0,8 |
|
107 |
32,4±0,4 |
38,3±0,5 |
28,9±0,4 |
34,0±0,5 |
31,3±0,4 |
36,7±0,5 |
29,6±0,4 |
|
Lactobacillus fermentum |
|||||||
|
105 |
106,2±1,5 |
94,0±1,3 |
68,9±0,9 |
77,1±1,1 |
85,6±1,2 |
87,0±1,2 |
92,2±1,3 |
|
107 |
52,1±0,8 |
46,7±0,6 |
32,4±0,4 |
34,6±0,5 |
35,0±0,5 |
44,2±0,6 |
48,9±0,7 |
|
Lactobacillus plantarum |
|||||||
|
105 |
53,4±0,7 |
59,0±0,8 |
62,5±0,9 |
60,6±0,8 |
55,2±0,8 |
57,3±0,8 |
64,2±0,9 |
|
107 |
25,5±0,4 |
28,7±0,4 |
31,4±0,4 |
29,7±0,4 |
27,5±0,4 |
28,7±0,4 |
32,1±0,4 |
|
Lactobacillus acidophilus |
|||||||
|
105 |
75,6±1,0 |
68,9±1,0 |
70,2±1,0 |
73,4±1,0 |
61,2±0,9 |
60,5±0,8 |
58,9±0,8 |
|
107 |
33,0±0,5 |
23,5±0,3 |
18,7±0,3 |
21,0±0,3 |
15,6±0,2 |
19,8±0,3 |
23,4±0,3 |