Д.А. Вульфова, Р.Ю. Ильяшенко, З.А. Сизова, Л.Л.
Лукацкая, А.О. Дорошенко
Научно-исследовательский
институт химии Харьковского национального
университета им. В.Н. Каразина. Украина,
61077, Харьков, пл. Свободы, 4
2-(5-[4-Диметиламинофенил]-2-оксазолил)-бензойная кислота как флуоресцентный сенсор для биологических объектов
Люминофоры,
относящиеся к классу 2,5-диарилоксазола, обладают оптическими свойствами, которые позволяют
использовать их в различных научных и технологических целях. Они находят
применение в синтезе пептидов [1], для установки флуоресцентных меток на
биологические объекты [1]. Карбокси-замещенные диарилоксазолы, обладают
биологической активностью [2], их используют в качестве противовоспалительных
средств [3] и регуляторов роста растений [4].
Объектом исследования
данной работы является 2-(5-[4-диметиламиинофенил]-2-оксазолил)-бензойная
кислота, которая была синтезирована из фталевого ангидрида и дигидрохлорида
ω-амино-4-диметиламиноацетофенона с последующей циклодегидратацией в серной
кислоте по схеме, аналогичной использованной в работе [5]:
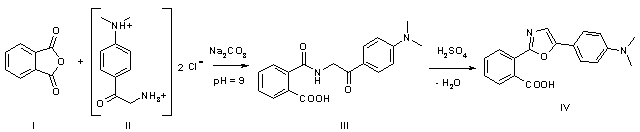
Изучаемое соединение
обладает высоким квантовым выходом в органических растворителях и низким в
водных средах, что определяет перспективу его использования в качестве
флуоресцентного зонда для биологических объектов. Нами проведено
кислотно-основное титрование в диапазоне от 9 до 1,5 единиц pH в среде
50 % об. этанол-вода и обнаружено существование двух равновесий, описываемых
константами рК1= 4,84![]() 0,11 и рК2= 2,68
0,11 и рК2= 2,68![]() 0,04.
0,04.
Вероятно,
константа рК1 соответствует диссоциации карбоксильной группы, т.к.
она близка по значению к константе диссоциации бензойной кислоты (4,20), рК2
– протонированию атома азота диметиламиногруппы, т.к. происходит в более кислой
среде и сопровождается коротковолновым смещением спектров поглощения. Протонирование
атома азота оксазольного цикла обычно происходит в интервале высоких
концентраций кислоты, который описывается функцией кислотности Гамета H0 (<-1) и не достигается в образцах биологической природы.
Следовательно, в физиологическом
интервале pH (![]() 5,5) соединение IV будет присутствовать преимущественно в
анионной форме. Это свойство должно способствовать более высокой растворимости
в водной среде, а также более прочному связыванию IV с белками.
5,5) соединение IV будет присутствовать преимущественно в
анионной форме. Это свойство должно способствовать более высокой растворимости
в водной среде, а также более прочному связыванию IV с белками.
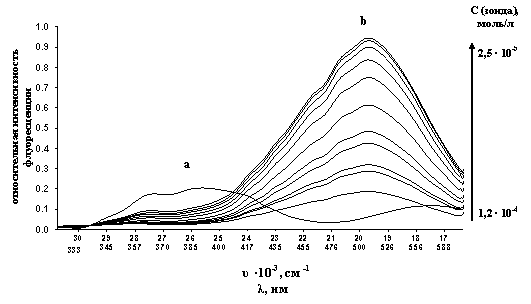
Рис. 1. (a) Спектр флуоресценции 10 %
спиртового раствора соединения IV с концентрацией 2,5 · 10-5 моль/л; (b) титрование белка САБ
исследуемым зондом.
Для проверки
данного предположения мы провели титрование альбумина сыворотки крови быка (САБ)
исследуемым зондом: к раствору белка концентрации 1·10-4 моль/л
прибавляли различные объемы раствора соединения IV в 10 % водном этаноле (рис. 1,
серия кривых b) в количествах не вызывающих изменение нативной
конформации белка (не более 6 об. %). При переходе из водного раствора в среду
биологического объекта, спектры флуоресценции соединения IV существенно изменяются (рис. 1).
Поскольку белок САБ не имеет собственной флуоресценции в диапазоне 500 нм, а
максимумы флуоресценции свободного зонда находятся при другой длине волны,
можно утверждать, что в биологической среде в спектре флуоресценции будут
представлены, главным образом, молекулы соединения IV, инкорпорированные в белковую
глобулу.
При концентрации зонда,
превышающей 2,5·10-5 моль/л наблюдается эффект насыщения при
заполнении зондом всех потенциальных мест связывания в белковой глобуле.
Константа связывания соединения IV с белком САБ была рассчитана по полученным
экспериментальным данным в области низких концентраций зонда и составила
3∙104 л·моль-1 (коэффициент корреляции R = 0,9968). На основании значения
константы было оценено изменение свободной энергии при переходе моля зонда из
воды в белковую глобулу: ΔG = -RT lnKc = -4,6∙10-3T lgKc (ккал/моль), которое составило для взаимодействия IV с САБ ~ -6,0 ккал/моль, что
характерно для невысокого вклада электростатических взаимодействиями по
сравнению с дисперсионными и гидрофобными взаимодействиями [6].
Литература
1. Prezhdo O., Lysova I., Distanov V., Prezhdo V. Synthesis and scintillating
efficiencies of 2,5-diarylthiazoles with intramolecular hydrogen bond // Tetrahedron
Letters. – 2004. – V. 45. – P. 5291-5294.
2. Sakakibara T., Kume T., Ohyabu T., Hase T. Aromatic carbonilation
regio-controlled by oxazole rings. novel route to heterocycle-substituted
o-benzoates // Chem. Pharm. Bull. - 1989. - V. 37, № 7.– P. 1694-1697.
3.
Short F., Long L. Synthesis of 5-aryl-2-oxazolepropionic acid and analogs.
anti-inflammatory agents // Journal of Heterocyclic Chemistry - 1969. - V. 6, №
5. – P. 707-712.
4. Liu K., Howe R. Photochemical synthesis of
2-(2-aryl-5 oxazolyl)benzoates // Organic Preparations and Procedures - 1983. -
V. 15, № 4.– P. 265-268.
5. Дорошенко А.О., Верезубова
А.А., Птягина Л.М. Синтез, спектральные свойства и структурная релаксация в
возбужденном состоянии полно-оксадиазольных орто-аналогов РОРОР // Вестник
Харьк. Нац. ун-та.- 2000.- № 477.- Химия. Вып. 5(28).- С.92-96.
6. Владимиров Ю.А., Добрецов
Г.Е. Флуоресцентные зонды в исследовании биологических мембран.- М.: Наука,
1980.- 320 с.