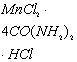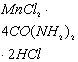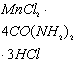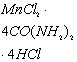1Колпек А., 1Еркасов
Р.Ш., 2Таутова Е.Н., 3Рыскалиева Р.Г.
Павлодарский
государственный университет им. С. Торайгырова
Кокшетауский
государственный университет им. Ш.Уалиханова
Казахский
национальный университет им. аль-Фараби,
СРАВНИТЕЛЬНЫЙ
КВАНТОВО-ХИМИЧЕСКИЙ АНАЛИЗ ЭЛЕКТРОННОЙ
СТРУКТУРЫ ПРОТОНИРОВАННЫХ
МАРГАНЕЦ КАРБАМИДНЫХ КОМПЛЕКСОВ
Актуальность
квантово-химических исследований, позволяющих получать информацию об
электронном строении соединений объясняется тем, что оно определяет химические
и физические свойства (реакционную способность, геометрию, спектральные
особенности) соединений.
Целью данного исследования являлось
получение с помощью полуэмпирического квантово-механического метода РМ3
некоторых электронных характеристик ряда координационных соединений хлорида
марганца с карбамид и протонированным карбамидом: ![]() ,
,
![]() ,
, ![]() ,
,
![]() ,
, ![]() , и их сравнительная
оценка. Интерес к изучению электронных характеристик указанных соединений
связан с установлением влияния протонирования молекул карбамида в исследуемых
комплексах, различным количеством молекул хлороводорода.
, и их сравнительная
оценка. Интерес к изучению электронных характеристик указанных соединений
связан с установлением влияния протонирования молекул карбамида в исследуемых
комплексах, различным количеством молекул хлороводорода.
Данные, полученные на основании проведенных
квантово-химических расчетах, представлены в таблице 1.
Информацию об электронном
перераспределении при протонировании молекулы комплекса карбамида
неорганической кислотой – хлороводородной – можно получить из анализа величин
эффективных зарядов на гетероатомах, входящих в состав исследованных молекул.
Эффективный заряд на атомах (q) является одним из важных электронных
параметров молекулы. В связи с тем, что
сами по себе эффективные заряды относятся к категории величин, трудно
определяемых экспериментально, так как прямых и практически удобных методов их
определения нет, зарядовые характеристики в использованном в данной работе
расчетном квантово-химическом методе РМ3, получены по Маликену [1, 2].
Таблица
1
Электронные и энергетические характеристики
протонированных карбамидных комплексов хлорида марганца
Соединения
Харак-
теристики
|
|
|
|
|
|
|
-DfН, кДж/ моль |
626,72 |
654,34 |
951,27 |
1265,99 |
1507,62 |
|
-Еtot, эВ |
4216 |
4548 |
4883 |
5218 |
5552 |
|
ПИ, эВ |
8,99 |
9,97 |
7,50 |
9,05 |
7,65 |
|
m, D |
8,94 |
7,36 |
8,71 |
7,56 |
7,16 |
|
q
(O), е.з. |
-0,415 -0,292 -0,172 -0,137 |
-0,336 -0,001 -0,001 -0,313 |
-0,352 -0,571 -0,394 -0,229 |
-0,456 -0,427 -0,622 -0,254 |
-0,594 -0,390 -0,179 -0,252 |
|
q (N1 ), е.з. |
-0,130 +0,652 +0,517 +0,299 -0,052 -0,044 -0,088 +0,143 |
+0,881 +0,446 +0,862 +0,049 +0,047 +0,034 -0,077 +0,091 |
+0,388 +0,205 +0,778 -0,033 +0,093 +0,440 +0,868 +0,007 |
+0,507 +0,613 +0,676 +0,621 -0,035 -0,104 -0,017 +0,058 |
+0,546 +0,633 +0,669 -0,201 -0,005 +0,112 -0,036 +0,572 |
Перераспределение
относительных эффективных зарядов на гетероатомах в молекулах карбамида –
атомах кислорода карбонильной группы и атомах азота аминогрупп, в исследуемых
координационных соединениях хлорида марганца, наблюдаемое при присоединении
молекул хлороводорода к атому карбонильного кислорода, объясняется происходящим
процессом протонирования. При этом происходит заметная поляризация всех атомов образующегося комплекса,
сказывающаяся, в первую очередь, на изменениях зарядовых характеристик
гетероатомов. Однако при анализе этих величин необходимо учитывать, что, так
как во всех квантово-химических расчетных схемах заложено определение
эффективного заряда на атоме по Маликену, оно не совпадает с действительным
распределением заряда вблизи конкретного атома. Дело в том, что заряд на атоме
определяется соответствующим коэффициентом сij, который отражает лишь формальный
относительный вес атомной функции в МО. Если такая функция диффузна, то заряд
по Маликену в действительности соответствует заряду большой области комплекса,
в которую входят не только центральный атом, но и атомы лигандов. Поэтому
определяемый по Маликену заряд на атоме обычно не совпадает с определенным
экспериментальным путем. Таким образом, рассчитанный квантово-химически заряд
является своего рода вспомогательным понятием, которое можно использовать лишь
в качественных оценках.
Сравнительная
качественная оценка проведенных квантово-химических расчетов, показала
нижеследующее. С увеличением протонизации исследуемых комплексов наблюдается увеличение
относительного отрицательного эффективного заряда на атоме карбонильного
кислорода и относительного положительного эффективного заряда на атоме аминного
азота по абсолютной величине по сравнению с исходной молекулой  . Это можно
объяснить тем, что процесс протонирования приводит к усилению амидного
сопряжения в исследуемых комплексах, что в свою очередь сказывается на данном
перераспределении относительного эффективного заряда на гетероатомах карбамида,
несмотря на присоединение атома водорода к атому карбонильного кислорода. Не
следует упускать из вида наличия электронного конкурентного влияния на атом
водорода, а также, на атом кислорода в
общем электронном поле, атома хлора
молекулы хлороводородной кислоты, через
связь
. Это можно
объяснить тем, что процесс протонирования приводит к усилению амидного
сопряжения в исследуемых комплексах, что в свою очередь сказывается на данном
перераспределении относительного эффективного заряда на гетероатомах карбамида,
несмотря на присоединение атома водорода к атому карбонильного кислорода. Не
следует упускать из вида наличия электронного конкурентного влияния на атом
водорода, а также, на атом кислорода в
общем электронном поле, атома хлора
молекулы хлороводородной кислоты, через
связь 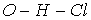 .
.
Анализ потенциалов ионизации (ПИ)
модельных координационных соединений, рассчитанных полуэмпирическим
квантово-химическим методом РМ3, позволяет сделать следующие заключение.
Первый потенциал ионизации, приведенный в таблице
для всех исследованных комплексов, определяется величиной заполненной МО (ВЗМО)
[3, 4].
Протонизация молекулы хлорида
тетракарбамидмарганца одной молекулой хлороводорода приводит к значительному
повышению первого потенциала ионизации молекулы – с 8,99 эВ до 9,97 эВ в
соединении
![]() , но, если в процесс
протонизации вовлечены четыре молекулы карбамида комплекса хлорида
тетракарбамидмарганца, то наблюдается уменьшение величины потенциала ионизации:
с 8,99 эВ до 7,50 эВ в соединении
, но, если в процесс
протонизации вовлечены четыре молекулы карбамида комплекса хлорида
тетракарбамидмарганца, то наблюдается уменьшение величины потенциала ионизации:
с 8,99 эВ до 7,50 эВ в соединении ![]() и до
7,65 эВ в соединении
и до
7,65 эВ в соединении
![]() .
.
Для исследуемых моделей рассчитаны величины
дипольных моментов (μ). Эта характеристика напрямую связана с электронным
строением рассматриваемых молекул. Наличие дипольного момента в нейтральных
молекулах марганца – карбамидных комплексов
обусловлено амидным сопряжением, имеющимся в молекулах карбамида [2, 4].
Анализ величин дипольных моментов исследованных
протонированных форм комплексов показывает, что наиболее высоким дипольным
моментом обладает молекула ![]() , а наименьшим –
молекула
, а наименьшим –
молекула
![]() . Таким образом,
протонизация приводит к уменьшению дипольного момента, при этом соединение,
имеющее в своем составе четыре протонированных атома кислорода карбонильных
групп молекул амида, обладает наименьшим значением μ.
. Таким образом,
протонизация приводит к уменьшению дипольного момента, при этом соединение,
имеющее в своем составе четыре протонированных атома кислорода карбонильных
групп молекул амида, обладает наименьшим значением μ.
Для всех исследованных в данной работе
протонированных моделей марганца – карбамидных комплексов рассчитаны теплоты образования. Из таблицы 1
следует, что протонирование приводит к увеличению устойчивости образующихся
соединений по сравнению с исходной молекулой, а также, что значения энтальпий
образования данных комплексов имеют отрицательные знаки, что указывает на
высокую их стабильность. При этом стабильность исследованных соединений возрастает
в ряду:
![]() <
< ![]() <
< ![]() < <
< <![]() <
<![]() ,
,
на что указывает увеличение энтальпий образования
указанных копмлексов по абсолютной величине, наблюдающееся в том же
направлении. Наиболее устойчивым соединением является молекула ![]() , энтальпия образования (-DfН) которой равна
–1507,62 кДж/моль.
, энтальпия образования (-DfН) которой равна
–1507,62 кДж/моль.
Для исследованных моделей производных ацетамида
рассчитаны величины полной энергии, которая представляет собой сумму
электронной энергии (потенциальной энергии электронов в молекуле) и энергии
отталкивания остовов (электростатического взаимодействия положительных точечных
зарядов). Для всех рассчитанных моделей наблюдается зависимость значений полной
энергии от их качественного состава и строения, что позволяет сделать вывод о
корректности расчета этой характеристики методом РМ3. Таким образом, анализ
рассчитанных теоретическим методом квантовой химии электронных характеристик
позволяет сделать вывод, что процесс протонирования приводит к существенным
изменениям электронных и энергетических параметров в исследуемых комплексах.
Литература:
1.
Кларк Т. Компьютерная
химия. М.: Мир, 1990. – 383 с.
2.
Берсукер И.Б.
Электронное строение и свойства координационных соединений. – Л.: Химия, 1976.
–352 с.
3.
Дей К., Селбин Д.
Теоретическая неорганическая химия. –М.: Химия, 1976. –568 с.
4.
Жидомиров Г.М., Багатурьянц А.А., Абронин И.А. Прикладная квантовая
химия. – М.: Химия, 1979. – 296 с.