Химия и химические технологии / 6. Органическая химия
К.х.н.
Карпинец А.П., Федорченко Д.Г.
Донецкий
национальный технический университет, Украина
КИНЕТИКА ЭЛЕКТРОВОССТАНОВЛЕНИЯ КАРБОНИЛЬНЫХ
СОЕДИНЕНИЙ В СИСТЕМАХ МЕТАНОЛ-БЕНЗОЛ
И МЕТАНОЛ-ДИОКСАН
В настоящее
время в практике электросинтеза [1] и электроанализа [2] органических веществ
широко применяются неводные растворители, в том числе смешанные. При исследовании
бинарных сред метанол-бензол и метанол-диоксан нам удалось существенно
расширить диапазон полярографирования карбонильных соединений до ε 6.4 и
установить природу межчастичных взаимодействий компонентов систем.
Полярограммы
регистрировали на приборе ПУ-1, используя ртутный капельный электрод с
характеристикой m2/3t1/6 2.40
мг2/3с-1/2. Деполяризаторы, растворители и компоненты
буферной системы рН 4.0 (ацетат лития, газообразный хлороводород) очищали по
стандартным [2] методикам. ИК спектры эквимолярных смесей метанол-бензол и
метанол-диоксан в СС14 записывали на спектрофотометре Specord-M 80 G. Спектры ПМР сканировали на приборе Tesla BS (100
МГц).
Все
изученные соединения образуют на полярограммах во всем интервале ε отчетливые
волны, предельный ток Іпр которых связан с
концентрацией деполяризатора и давлением ртути зависимостями Іпр = к1 ∙ С, Іпр = k2√h. В то же время
завышенные значения энергии активации Іпр (18-20
кДж-моль-1) и снижение Іпр во
времени (обычно 1с - 40мин) указывают на кинетическую составляющую,
обусловленную накоплением в системе полуацеталей [3].
В
таблице 1 указаны рассчитанные по уравнению обратимой реакции первого порядка
(избыток СН3ОН) кинетические параметры процесса полуацетализации.
Видно, что склонность к образованию полуацеталей наиболее выражена у n-галогензамещенных бензальдегида, это согласуется с
нуклеофильным характером присоединения метанола. Различие в поведении
гетероциклических аналогов обусловлено индуктивным влиянием атомов О и S.
Поскольку
и процесс электровосстановления альдегидов и кетонов протекает с участием
карбонильной группы естественно, что и полярографические характеристики также
определяются электронной плотностью на ней. Поэтому соблюдается хорошая
корреляция (r 0.98) значений Е1/2 и
k1, К (таблица
2). (Здесь: m-мольная доля метанола, ε,
η – диэлектрическая проницаемость и динамическая вязкость среды сПз).
Смещение Е1/2 всех соединений в более катодную область по мере
увеличения содержания бензола в растворе обусловлено суммарным действием
следующих факторов: снижением ε, изменением межфазового потенциала и
сольватации. Аналогичная картина и корреляции характерны и для метанол-диоксановых
систем.
При сопоставлении
кинетических характеристик реакции полуацеталнзации в средах, состоящих из
различных количеств метанола и диоксана (таблица 1), отчетливо прослеживается заметное
влияние на них состава среды. Значения k снижаются, а К возрастают по мере уменьшения
содержания спирта в смешанном растворителе. Причиной увеличения К является
снижение ε среды, которое усиливает взаимодействие полярных гидроксильной
и карбонильной групп реагентов. Вместе с тем повышение вязкости системы
затрудняет перемещение реагирующих веществ и вызывает снижение значений k как в метанол-диоксановых, так и в метанол-бензольных
растворах (таблица 2).
При сравнении
данных таблиц 1, 2 интересно отметить следующее. В изодиэлектрических средах с
небольшим содержанием диоксана (< 0.1 мол.доли) величины k и К уменьшаются не более чем на 15% по сравнению с
таковыми для метанол-бензольных сред. Введение больших количеств диоксана
(>0.267 мол. доли) приводит к существенному снижению скорости процесса. Это
явление может быть обусловлено возможными структурными и ассоциативными превращениями
компонентов системы метанол-диоксан.
Результаты
проведенного физико-химического анализа: отрицательные значения изменения
мольного объема ΔΘ и положительные отклонения плотности Δd от аддитивных величин - указывают на небольшое сжатие
в системе метанол-диоксан, причиной которого обычно полагают [4] образование смешанных
ассоциатов. Сравнительно малые величины Δd и ΔΘ (менее 1% от абсолютных значений) и
отсутствие четких максимумов на кривых состав-свойство указывают на то, что при
концентрациях спирта в системе 0.08-0.98 мол.доли (1.0-24.74 мольл-1)
заметное взаимодействие метанол-диоксан не имеет места.
Это
подтверждают и полученные нами спектры ПМР системы. Обнаружено, что диоксан
сильнее «разрушает» ассоциаты метанола, чем более инертный растворитель СС14.
Вместе с тем степень ассоциации спирта в широком интервале концентраций,
включая его растворы с мол.долей 0.05, остается неизменной и равной 4 [5].
Очевидно, такое разрушение проявляется в изменении структуры тетрамеров,
большинство которых находится в виде цепочечных неразветвленных ассоциатов [5].
Структурным превращениям ассоциатов метанола благоприятствует и склонность к
конформационным превращениям самих молекул диоксана [5]. Указанные
преобразования бинарного растворителя затрудняют протекание полуацетализации,
весьма чувствительной к стерическим эффектам [3]. Наблюдаемое смещение сигнала
ОН-группы спирта в область слабых полей в случае его бензольных растворов
(0.25-0.90 мол.доли) обусловлено преимущественно анизотропией бензольного
кольца [6].
Дальнейшее
исследование состояния растворителей осуществляли с помощью ИК спектроскопии.
При этом установлено, что в 1 м. растворе в СС14 метанол находится
преимущественно в ассоциированной форме: поглощение ОН-группы тетрамера
характеризуется широкой полосой с максимумом 3344 см-1. При
последующем разбавлении раствора (0.1 моль л-1) образуются главным
образом димеры с v (OH) 3532 см-1, мономеры с 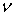 (OH) 3640 см-1 начинают преобладать при
концентрациях 0.02 моль л-1. При сравнении частот полос валентных
колебаний ОН-группы подтверждается ранее [6] обнаруженное явление, а именно:
Н-связи тетрамеров более чем в два раза стабильнее, чем у димеров, Δ
(OH) 3640 см-1 начинают преобладать при
концентрациях 0.02 моль л-1. При сравнении частот полос валентных
колебаний ОН-группы подтверждается ранее [6] обнаруженное явление, а именно:
Н-связи тетрамеров более чем в два раза стабильнее, чем у димеров, Δ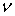 (OH) соответственно 296 и 108 см-1.
(OH) соответственно 296 и 108 см-1.
Прибавление
к спирту эквимолярных количеств диоксана вызывает длинноволновое смещение полос
поглощения ОН-группы (см-1): на 128 - у мономера, на 86 - у димера и
на 56 - у тетрамера. Аналогичные изменения 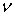 (OH) в эквимолярной системе метанол-бензол достигают лишь 58,
26 и 18 см-1. В итоге образование смешанных ассоциатов происходит
лишь в довольно разбавленных растворах, при этом межмолекулярная водородная
связь в системе метанол-диоксан более прочная, чем метанол-бензольных средах.
(OH) в эквимолярной системе метанол-бензол достигают лишь 58,
26 и 18 см-1. В итоге образование смешанных ассоциатов происходит
лишь в довольно разбавленных растворах, при этом межмолекулярная водородная
связь в системе метанол-диоксан более прочная, чем метанол-бензольных средах.
Таким образом, в бинарных
растворителях метанол-диоксан и метанол-бензол в широком интервале концентраций
происходят различные структурные и ассоциативные превращения. Они в конечном
итоге определяют состояние деполяризатора в растворе и прежде всего его
полярографически активную концентрацию.
Литература:
1.
Гультяй В. П., Кривенко
А. Г., Томилов А.П. Электрохимия органических соединений в начале XXI века.–
М.: Компания Спутник +, 2008. – 578 с.
2.
Райхардт К. Растворители
и эффекты среды в органической химии. М.: Мир, 1991. – 763 с.
3.
Яновская
Л.А., Юфит С.С., Кучеров В.Ф. Химия ацеталей. М.: Наука, 1975. – 275 с.
4.
Никифоров
М.Ю., Альпер Г.А., Дуров В.А. Растворы неэлектролитов в жидкостях. М.: Наука,
1989. – 263 с.
5.
Ельяшевич
Б.И. Атомная и молекулярная спектроскопия. М.: Эдиториа, 2001. – 896 с.
6.
Браун
Д., Флойд А., Сейнзбери М. Спектроскопия органических веществ. – М.: Мир, 1992.
– 300 с.
![]() (OH) 3640 см-1 начинают преобладать при
концентрациях 0.02 моль л-1. При сравнении частот полос валентных
колебаний ОН-группы подтверждается ранее [6] обнаруженное явление, а именно:
Н-связи тетрамеров более чем в два раза стабильнее, чем у димеров, Δ
(OH) 3640 см-1 начинают преобладать при
концентрациях 0.02 моль л-1. При сравнении частот полос валентных
колебаний ОН-группы подтверждается ранее [6] обнаруженное явление, а именно:
Н-связи тетрамеров более чем в два раза стабильнее, чем у димеров, Δ![]() (OH) соответственно 296 и 108 см-1.
(OH) соответственно 296 и 108 см-1.![]() (OH) в эквимолярной системе метанол-бензол достигают лишь 58,
26 и 18 см-1. В итоге образование смешанных ассоциатов происходит
лишь в довольно разбавленных растворах, при этом межмолекулярная водородная
связь в системе метанол-диоксан более прочная, чем метанол-бензольных средах.
(OH) в эквимолярной системе метанол-бензол достигают лишь 58,
26 и 18 см-1. В итоге образование смешанных ассоциатов происходит
лишь в довольно разбавленных растворах, при этом межмолекулярная водородная
связь в системе метанол-диоксан более прочная, чем метанол-бензольных средах.