И.В.Бондарь, Е. Стецюк
Днепродзержинский
государственный технический университет
ОТРАБОТКА ТЕХНОЛОГИИ
ПОЛУЧЕНИЯ ПИТАТЕЛЬНЫХ СРЕД,
ПРИГОТОВЛЕННЫХ НА ОСНОВЕ КУКУРУЗНОЙ МУКИ, ДЛЯ
КАРОТИНОСИНТЕЗИРУЮЩЕГО ГРИБА BLAKESLEA TRISPORA
Пищевые красители используют для окрашивании
продуктов, утративших естественный цвет в процессе технологической обработки;
для получения определенной стандартами окраски готового продукта; для улучшения
органолептических показателей пищевых
изделий и напитков, а также для витаминизации и повышения биологической
и пищевой ценности ряда пищевых продуктов. Натуральные красители, как правило,
в своем составе кроме красящих пигментов имеют целый комплекс биологически
активных веществ: витамины, органические кислоты, ароматические вещества,
микроэлементы. Поэтому их использование позволяет не только улучшить внешний
вид, но и повысить пищевую ценность изделий.
На ООО НПП ”Витан“ была разработана
технология получения натурального пищевого красителя - микробиологического
β-каротина, включающая обработку растительного сырья (кукурузной муки)
различными амилолитическими ферментными
препаратами основных мировых производителей амилолитических ферментов,
поставляющих свою продукцию на рынок Украины.
Поступающее на производство
растительное сырье, такое как кукурузный экстракт, имеет вариабельный состав – оно может быть выработано
из недозрелого зерна кукурузы с нестабильным уровнем экстрактивных веществ, а следовательно с высоким уровнем
растворимых белков (растворимого азота)
и растворимого крахмала. Эти белки, переходящие в растворимое состояние,
активно вступают в реакцию Майлара (сахаро-аминная реакция), что приводит к
увеличенному образованию оксиметилфурфурола и токсичных для гриба продуктов,
поэтому экстракт (как и жир) надо добавлять в питательные среды после
осахаривания, особенно при использовании кукурузного экстракта из незрелой
кукурузы. Кроме того, протеолитические
белки ингибируют амилолитические ферменты.
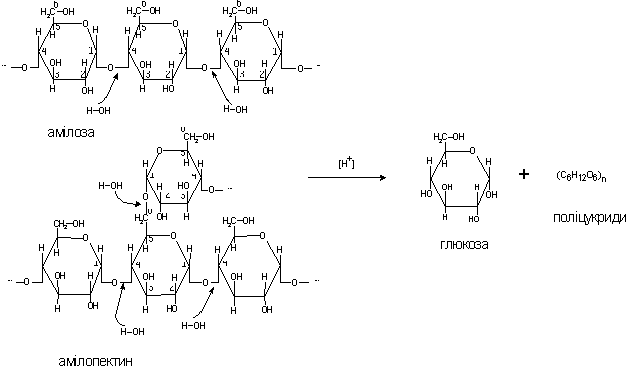
Для
получения глюкозы крахмал
гидролизуют в две стадии: на
первой стадии в виде гидросуспензии при температуре 140-145°С
и давлении 2,8-3,2 кгс/см2, в присутствии катализатора – соляной кислоты.
Полученную смесь
глюкозы и низкомолекулярных продуктов расщепления
крахмала после доведения
ее температуры до 58-65°С и рН
до 4.5-4.9 направляют на другую стадию осахаривания – с помощью фермента
глюкоамилазы .
При катализе
соляной кислотой сначала возникает
ослабление и разрыв ассоциативных
связей между макромолекулами амилопектина и амилозой (основные составляющие
части крахмала), которое сопровождается разрушением структуры
крахмальных зерен и образованием
гомогенной массы. В ходе дальнейшего
воздействия кислоты в
полисахаридах разрываются
валентные α-1.4- и α-1.6 – глюкозные связи
и по месту разрыва каждой
связи присоединяется молекула воды:
 Полученная
смесь полисахаров расщепляется до глюкозы с помощью
фермента глюкоамиазы (екзо-1.4-
Полученная
смесь полисахаров расщепляется до глюкозы с помощью
фермента глюкоамиазы (екзо-1.4-![]() -глюкозидаза; (3.2.1.3)-1.4-
-глюкозидаза; (3.2.1.3)-1.4-![]() -D-глюкан-глюкогидролаза),
которая вызывает последовательное отцепление остатков глюкозы от
нередуцирующих концов олигосахаридов
с разрывваом
-D-глюкан-глюкогидролаза),
которая вызывает последовательное отцепление остатков глюкозы от
нередуцирующих концов олигосахаридов
с разрывваом ![]() -1.4- и
-1.4- и ![]() -1.6-глюкозидных связей
и присоединением молекул воды по
месту разрыва(аналоично схеме
кислотного гидролиза). После второй
стадии осахаривания
получают глюкозу с примесью небольшого количества сахаров.
-1.6-глюкозидных связей
и присоединением молекул воды по
месту разрыва(аналоично схеме
кислотного гидролиза). После второй
стадии осахаривания
получают глюкозу с примесью небольшого количества сахаров.
(С6Н10О5)n + nН2О ® nС6Н12О6
Цель проведенных исследований:
Проверить эффективность проведения
ферментации с целью
получения высокого уровня синтеза
β-каротина и биомассы на специально подготовленных питательных средах (после предварительной обработки
кукурузной муки амилолитическими
ферментными препаратами).
Нами
применялись следующие схемы
введения ферментных препаратов:
–
с помощью двухферментной системы – первоначально, разжижающей бактериальной α-амилазой Termozyme
L-340 (1-й этап) и, затем, осахаривающей
до глюкозы глюкоамилазой Glucozyme l-400 (2-й этап);
– с помощью одноферментной системы на
основе бактериальной α-амилазы, вводимой дробно – в начале гидролиза и на
45 мин термолиза - такая схема гидролиза мучной крупки впервые была
использована на крахмало-паточном заводе в Южной Африке в середине 70-х годов.
Согласно вышеупомянутой технологии, измельченное кукурузное зерно разжижали бактериальной α-амилазой при
температуре 85ºС под давлением 5 кгс/см.
Установлено, что одноферментная система
имеет по сравнении с двухферментной следующие преимущества:
– реакция проводится при температуре 85–90
ºС, в связи с чем снижается возможность
контаминации;
– после установления начального значения
рН далее не требуется корректировка сред по активной кислотности;
- снижаются затраты на фермент;
– уменьшается опасность протеолиза, т.к.
процесс осуществляется при такой температуре (85–95) ºС, когда
протеолитическая активность почти полностью инактивируется, и конечные продукты гидролиза содержат незначительное
количество азотистых веществ.
В ходе приготовления питательных сред
нами вводилось определенное количество
карбоната кальция (мела) – известно, что α-амилаза является
металлоферментом - на каждую молекулу фермента приходится один атом кальция. С
целью стабилизации каталитической активности
против таких отрицательных факторов, как нагревание, изменения значения
рН и особенно, протеолиза, в суспензию крахмалосодержащего материала –
кукурузной муки, перед разжижением в крахмалопаточном производстве добавляют
0,05% соли кальция к массе крахмала.
Это повышает амилолитическую активность и снижает конечную вязкость гидролизата
(по литературным сведениям примерно в три раза при 70 ºС).
Среду для маточных колб готовили на основе
кукурузной и соевой муки. Она
имела состав (г/л): мука кукурузная – 47; мука соевая – 28; тиамина хлорид –
0,0002; КН2РО4 – 0,5. Ферментационные колбы засевали питательной
средой состава (г/л): мука кукурузная – 12; экстракт кукурузный – 30; масло
растительное – 1,75 мл/50 мл среды.
Примечание. Используемая кукурузная мука должна быть
обезжиренной или с низким содержанием жира. Установлено, что жир и жирные
кислоты ингибируют амилолитические
ферменты. Поэтому растительный жир в питательную среду надо вводить после введения всех остальных компонентов. В таблице 1 приведена краткая характеристика
используемых ферментов.
Таблица 1- Ферментативная активность
использованных в опыте ферментов
|
Наименование образца |
Активность, GAU/г*, ед/ см3 |
|
Альфа- амилаза Termozyme L-340 |
598,9 |
|
Глюкоамилаза Glucozyme l-400 |
5152 |
*
Глюкоамилазная едииница (GAU, Glukoamylase Activity Unit) количество фермента, которое помогает получить 1г
редуцирующих веществ, включая
глюкозу, из растворимого
крахмального субстрата в течение
1 час при соблюдении
оптимальных условий
действия фермента.
Приготовление питательных сред проводилось в указанной ниже последовательности ( пп.1-3; таблица 2):
1.
При непрерывном
перемешивании в 2,0 дм3 водопроводной воды вводили 24 г
кукурузной муки.
2.
Смесь термостатировали
на водяной бане при температуре (45±2) ºС в
течение 30 мин при непрерывном помешивании.
3.
Мучную суспензию разделяли
на четыре равные части по 500 мл
каждая.
Таблица 2 – Общая схема введения амилолитических ферментов и режимы
ферментолиза
|
Вариант №1
– классический – двухстадийная обработка в разных температурных режимах (с
учетом температурных
оптимумов работы каждого
из ферментов) |
Вариант №2
– |
Вариант №3 – ступенчатый ферментолиз с помощью
одного фермента- |
Контроль –
№4 |
|
1 |
2 |
3 |
4 |
|
4. Довели рН
среды до 6,5 с помощью
концентрированной серной кислоты |
4. Довели рН
среды до 5,5 с помощью концентрированной серной кислоты |
4. Довели рН
среды до 6,5 с помощью
концентрированной серной кислоты |
4. Добавили 15 г кукурузного экстракта (на 500 мл среды), перемешали. Довели рН среды до 6,5 |
|
1 |
2 |
3 |
4 |
|
5. С помощью микропипетки ввели фермент α-амилазу в количестве 0,015
мл |
5. Ввели
фермент |
5. Ввели фермент |
5. Без изменения |
|
6. Без изменения |
6. Ввели
фермент глюкоамилазу в количестве 0.054 мл |
6. Без изменения |
6. Без изменения |
|
7. Ввели
мел в количестве 0.02 г |
7.Ввели мел
в количестве 0.02г |
7. Ввели мел
в количестве 0.02г |
7. Без изменения |
|
8. Провели
гидролиз при температуре 85–90 ºС в течение 45 мин |
8. Провели
гидролиз при температуре 50
ºС в течение 160 мин |
8. Провели
гидролиз при температуре 85-90ºС в течение 90 мин |
8. Без изменения |
|
9. Определили
физико-химические показатели: рН, редуцирующие вещества (РВ)- с гидролизом и без гидролиза рН – РВ – 1,01 % РВ – 0,21% |
9. Определили
физико-химические показатели: рН, редуцирующие вещества (РВ)- с гидролизом и без гидролиза: РВ – 1,21% РВ – 0, 67% |
9. Определили физико-химические показатели: рН,
редуцирующие вещества (РВ)- с
гидролизом и без гидролиза: РВ – 1,35% РВ – 0,40% |
9. Определили
физико-химические показатели: рН, редуцирующие вещества (РВ) с гидролизом
и без гидролиза: РВ – 1,03% РВ – 0,0% |
|
10. Охладили смесь до температуры |
10. Без изменения |
10. Без изменения |
10. Без изменения |
|
11. Довели рН до |
11. Без изменения |
11. Без изменения |
11. Без изменения |
|
12. Ввели фермент
глюкоамилазу в количестве 0,027 мл., согласно задания и провели гидролиз в течение
2-х часов при (45–50) ºС |
12. Без изменения |
12. Без изменения |
12. Без изменения |
|
1 |
2 |
3 |
4 |
|
13. Добавили 15
г кукурузного экстракта (на 500 мл среды), перемешали |
13. Добавили
15 г кукурузного
экстракта (на 500 мл среды),
перемешали |
13. Добавили 15
г кукурузного экстракта (на
500 мл среды), перемешали |
13. Без изменения |
|
14. Довели рН питательной среды до 6,5. |
14. Довели
рН питательной среды до 6,5 |
14. Довели рН питательной среды до 6,5 |
14. Довели рН питательной среды до 6,5 |
|
15. Разлили в пять ферментационных колб по 52,5 мл и добавили масло по 1,75 мл/колбу |
15. Разлили в пять ферментационных колб по 52,5 мл и добавили масло по 1,75 мл/колбу |
15. Разлили в пять ферментационных колб по 52,5 мл
и добавили масло по 1,75 мл/колбу |
15. Разлили в пять ферментационных колб по 52,5 мл и добавили масло по 1,75 мл/колбу |
|
16. Простерилизовали при температуре 120 ºС в течение 40 мин |
16. Простерилизовали при температуре 120 ºС в течение 40 мин |
16. Простерилизовали при температуре 120 ºС в
течение 40 мин |
16.
Простерилизовали при температуре 120 ºС в течение 40 мин |
|
17. Определили
физико-химические показатели: рН, редуцирующие вещества, аминный азот |
17. Определили физико-химические показатели: рН, редуцирующие вещества, аминный азот |
17. Определили физико-химические показатели: рН, редуцирующие вещества, аминный азот |
17. Определили
физико-химические показатели: рН редуцирующие вещества, аминный азот |
Таблица 3 – Биохимический состав
питательных сред, обработанных амилолитическими ферментами после автоклавирования при (120±2) ºС в течение 40 мин
|
Показатель |
Вариант №1 |
Вариант №2 |
Вариант №3 |
Контроль - №4 (без ферментов) |
|
рН |
6,15 |
6,1 |
6,2 |
6,3 |
|
Азот аминный, мг/% |
98 |
57 |
98 |
64,4 |
|
Редуцирующие вещества, % |
1,2 |
1,27 |
1,55 |
0,94 |
Таблица 4 – Результаты модельной ферментации на колбах с амилолитическими
ферментами
|
№№ образцов |
Вариант №1 |
Вариант №2 |
Вариант №3 |
Контроль –
№4 (без ферментов) |
|
Содержание β-каротина, г/л |
||||
|
1 |
2,87 |
1,72 |
2,05 |
1,52 |
|
2 |
1,8 |
1,71 |
1,53 |
1,79 |
|
3 |
1,76 |
1,61 |
1,80 |
1,43 |
|
Среднее значение |
2,14 |
1,68 |
1,79 |
1,58 |
|
Содержание биомассы, г/л |
||||
|
1 |
19,2 |
19,9 |
20,6 |
17,9 |
|
2 |
20,3 |
18,4 |
17,6 |
20,1 |
|
3 |
20,4 |
18,3 |
19,1 |
17,8 |
|
Среднее значение |
19, 97 |
18,9 |
19,1 |
18,6 |
|
Содержание β-каротина, % |
||||
|
1 |
14,9 |
8,6 |
9,95 |
8,49 |
|
2 |
8,9 |
9,29 |
8,7 |
8,9 |
|
3 |
8,6 |
8,8 |
9,47 |
8,0 |
|
Среднее значение |
10,8 |
8,9 |
9,37 |
8,47 |
Таблица 5 - Примерный расчет сырья на одну
промышленную ферментацию с амилолитическими ферментами
|
Наименование ресурса |
7000 литров |
|
Крахмал в сырье |
50,05 кг |
|
Кукурузная мука (средняя крахмалистость 71,5%) |
70 |
|
Процессная питьевая вода |
6580 |
|
Масло растительное |
160 кг |
|
Экстракт кукурузный |
190–210 кг |
|
Каустик |
До рН 6,3 |
|
Сернистая кислота |
до рН 4,0–5,5 |
|
Хлористый кальций |
210 г |
|
Альфа-амилаза |
1050 мл |
|
Глюкоамилаза |
600 мл |
Результаты: Полученные результаты ферментации на питательных
средах, предварительно обработанных комплексом амилолитических ферментов Termozyme L-340 (1-й этап) и, затем,
осахаривающим до глюкозы ферментом
глюкоамилазой Glucozyme l-400 (2-й этап) прошли с увеличением содержания
β-0 каротина в среднем на 29,2 %, а в отдельных вариантах - на 48% и показали максимальные результаты по
сравнении с другим испытанными вариантами. Результаты исследований показали,
что не целесообразно вводить оба фермента вместе, т.к. первый фермент –
α-амилаза, плохо работает при температуре, оптимальной для глюкоамилазы,
т.е. при (50-45) ºС. Кроме того, в результате
проведения ряда биохимических анализов,
было показано, что после стерилизации в кукурузной муке все еще остается много
аминного азота и сахаров, которые гриб
сможет утилизировать только под действием ферментов ( своих или
введенных в среду извне). Что происходит с остальными редуцирующими
веществами по ходу ферментации необходимо установить в ходе дополнительных
биохимических исследований - очевидно,
они извлекаются из муки и потребляются
грибом в результате выработки
собственных α-амилаз, глюкоамилаз или других видов амилолитически
ферментов.
Т.о.,
последовательная обработка ферментами-α-амилазой и глюкоамилазой, показывает очевидное преимущество ферментолиза
кукурузной муки комплексом амилолитических ферментов, работающих в разных
температурных режимах, по сравнению с контролем (как по съему β-каротина, так и по биомассе).
Оптимистическими выглядят и результаты, полученные при ступенчатой обработке
кукурузной муки одним амилолитическим ферментом – термостабильной
α-амилазой. В этом случае также получено превышение как по содержанию β-каротина, так и по биомассе (соответственно на 12% и 3%). По
сравнению с увеличением выхода целевого продукта и экономией пара и
электроэнергии возрастание стоимости питательной среды за счет использования ферментов является несущественным.