Биологические науки/ 8.Физиология человека и животных.
Канд. биол. наук Арешидзе Д.А., Козлова М.А., д-р биол. наук Снисаренко Т.А., канд. биол. наук Мутыгуллина Ю.Р., Сёмин И.А.
Московский государственный областной
университет, Россия
Применение ферментативного гидролизата Хлорофитума хохлатого
при экспериментальном токсическом повреждении печени крыс в возрасте трех
месяцев.
В современной научной литературе
встречаются единичные сообщения о лечебных свойствах растения Хлорофитум
хохлатый. Показано, что листья растения обладают высокими сорбционными
свойствами в отношении формальдегида, угарного газа,
бензола, трихлорэтилена, фенолов и ряда других веществ [2,3,7]. При
химическом анализе ферментативного гидролизата Хлорофитума хохлатого в его
составе был обнаружен ДL - орнитин
моногидрохлорид, обладающий дезинтоксикационным и гепатопротективным действием [4,8].
Эти факты позволяют рассматривать данный
гидролизат как биологически активную субстанцию, обладающую гепатопротекторными
свойствами, что позволяет авторам продолжать целенаправленное изучение влияния
гидролизата на регенераторный потенциал печени млекопитающих. Для проверки предположения
об эффективности биостимуляции нами было проведено исследование, целью которого
явилось изучение степени тяжести поражения печени ССl4 при одновременном
приёме ферментативного гидролизата Хлорофитума хохлатого.
При
исследовании эффективности влияния биологически-активных веществ на печень в
различные периоды онтогенеза нами было использовано 90 белых крыс линии Вистар
в возрасте 3-х месяцев:
·
животных, ингалируемых
четыреххлористым углеродом по 2 мин. в сутки в течение 6 дней (контрольная
группа);
·
животных, ингалируемых
четыреххлористым углеродом по 2 мин. в сутки в течение 6 дней, но одновременно
получавших с питьем ферментативный гидролизат хлорофитума хохлатого в дозе
0,6мг на 100г массы тела (экспериментальная группа).
Выбор
четыреххлористого углерода (CCl4) в качестве агента, действующего на
печень, объясняется тем фактом, что это вещество является прямым печеночным
ядом, широко используемым в экспериментальной медицине и биологии [1]. Выбор
продолжительности токсического и гепатопротективного воздействия определяется
тем, что применение четыреххлористого углерода по данной схеме обеспечивает
возникновение и развитие обратимых изменений в печени на тканевом и органном
уровне [5].
Все
исследованные органы отбирались после усыпления животных под эфирным наркозом.
После фиксации материала 10%-нейтральным забуференным формалином для части
органов проводилась проводка по общепринятой методике с последующей заливкой в
парафин. При проведении исследований органов, залитых в парафин, приготовлялись
серийные срезы толщиной 5-6 мкм.
Гистологические срезы были получены на
санном микротоме «МС – 2», для гистохимического определения липидов
использовали замораживающий столик «СМЗ – Уником». Окраска гематоксилин-эозином
осуществлялась по общепринятой методике. Окрашенные срезы заключали в бальзам.
Для
выявления апоптических клеток полутонкие срезы окрашивались метиленовым
синим-азуром II с докраской фуксином [6]. Апоптический
индекс вычисляли по формуле [10]:
АИ = Na / N,
где Na – количество апоптических клеток;
N – общее количество клеток в исследуемой совокупности.
Митотический индекс определяли по формуле:
МИ = Nm / N,
где Nm – число митозов;
N – общее количество клеток в исследуемой совокупности.
Некротический индекс
вычисляли по формуле [9]:
НИ = Nn
/ N,
где Nn– количество
некротических клеток;
N – общее количество клеток в исследуемой
совокупности.
Для оценки степени
повреждения печени нами так же определялись следующие параметры: содержание
билирубина, ALT и AST в крови.
При патоморфологическом исследований
печени крыс, подвергшихся воздействию четырёххлористого углерода нами была
обнаружено, что орган животных имел красный цвет, иногда с желтоватым или серым
оттенком. У 20% крыс печень была пятнистой. Орган рыхлый, легко рвется, на разрезе
сочится кровь.При гистологическом исследовании отмечается
чётко выраженная дискомплексация печеночных балок. Гепатоциты, набухшие,
цитоплазма их мутная, границы клеток не четкие, ядра также набухшие, светлые,
со смазанными контурами. В гепатоцитах отчетливо наблюдаются прозрачные вакуоли.
При окраске суданом-III в 65% месяцев в вакуолях
гепатоцитов выявляются липиды. В печени крыс отдельные гепатоциты в состоянии
зернистой дистрофии. Сосуды печени в различных участках среза неравномерно
расширены и кровенаполнены, в области триад и периваскулярно признаки слабой
мезенхимальной реакции.
В ряде случаев отмечаются
соединительнотканные прослойки, значительные в области триад, инфильтрированы
мелкими клетками, утолщены. Кровеносные сосуды (центральные вены, капилляры) в
печени расширены (гиперемия кровеносных сосудов), проницаемость стенок для
клеток крови повышена, отмечаются очаговые кровоизлияния. Среди клеток большое
количество лейкоцитов, макрофагов. В гепатоцитах большое количество вакуолей, в
том числе липидных, что подтверждается окраской суданом – ІІІ. Отдельные клетки
очень крупные и фактически представляют собой сплошную вакуоль
В 70% случаев обнаружены множественные
очаги некрозов разных размеров, в которых структурные элементы отдельных клеток
не визуализируются, а ткань печени представляет собой гомогенную бесструктурную
массу. В 30 % случаев отмечаются обширные некрозы.
Обнаруженные изменения свидетельствуют о
развитии у животных подгрупп типичной токсической дистрофии печени. Однако у
некоторых крыс установленная микрокартина характерна для развития очагового
альтеративного воспаления. У значительной части крыс отмечена картина острого
токсического гепатита, с достаточно высокой интенсивностью повреждения тканей
(альтеративный гепатит). У части животных определяется гепатоз с выраженным некротическим
компонентом.
Применение гидролизата Хлорофитума
хохлатого при одновременной ингаляции ССl4 в печени
что патологические изменения в органе носят значительно меньшую выраженность.
Так, в печени всех животных прослеживается балочное и дольчатое строение. При
этом немногочисленные очаги дистрофии чередуются с участками, представленными с
неповрежденными и двуядерными гепатоцитами (признаки регенерации) или с
гепатоцитами в состоянии начального этапа зернистой дистрофии, Жировая
дистрофия встречается в 15%. Так же существенно меньше гепатоцитов в состоянии
некрозов. Отмечено отсутствие очаговых кровоизлияний, межбалочные капилляры
умерено гиперемированы, отсутствуют и признаки отечности, и снижается
проницаемость, которые зарегистрированы в группе без применения гидролизата.
Сосуды в области триад умеренно расширены. При этом в 28% гепатоцитов отмечены
мелкие вакуоли (рис.1).
Величина МИ в печени животных контрольной
группы составила 2,4±0,041%, АИ – 6,2±0,2% НИ – 4,0±0,042%. Применение
ферментативного гидролизата Хлорофитума хохлатого при экспериментальном
токсическом повреждении печени приводит к тому, МИ составляет 9,75±0,5%, АИ –
0,7±0,2%, НИ – 2,1±0,042%. (рис. 2).
Результаты
исследования показали, что применение гидролизата хлорофитума хохлатого при
токсическом повреждении печени приводит к существенному снижению уровня ALT (2,03±0,1 мкмоль/л в контроле против 1,7±0,1 мкмоль/л в крови
крыс, принимавших гидролизат) и AST(1,97±0,06 мкмоль/л в контроле против 1,4±0,1 мкмоль/л в крови
крыс, принимавших гидролизат). Так же
отмечено снижение содержания билирубина в крови экспериментальных животных до
6,7±0,12 мкмоль/л при 10,03±0,1 мкмоль/л
в контроле (рис. 3).
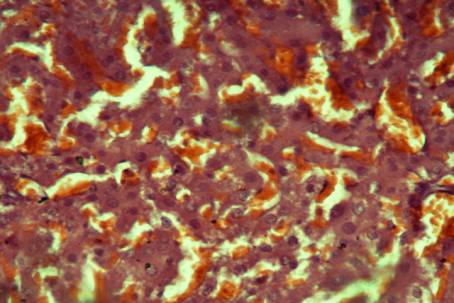
Рис. 1. Печень крыс контрольной группы месяцев после воздействия ССl4.
Окраска гематоксилином-эозином, × 200.
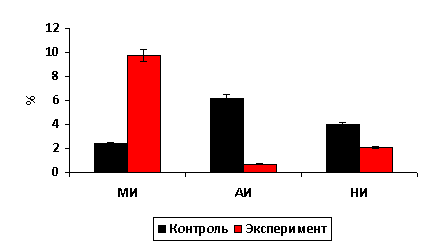
Рис. 2. Величина МИ, АИ и НИ в печени крыс.
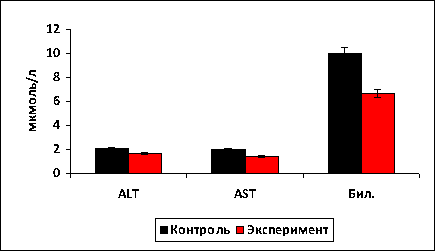
Рис. 3. Уровень ферментов и билирубина в крови крыс исследованных групп.
Проведенные исследования позволяют сделать вывод о том, что ферментативный гидролизат Хлорофитума хохлатого обладает значительными гепатопротективными свойствами, снижает интенсивность воспалительного процесса, усиливает антиоксидантную активность печени, восстанавливает метаболизм в гепатоцитах. Ярко выражено положительное влияние гидролизата на процессы регенерации печени, о чем свидетельствуют различия митотического, некротического, апоптического индексов и скорости пролиферации в исследованных группах.
Литература.
1. Блюгер, А.Ф.
Практическая гепатология / А.Ф. Блюгер, И.Н. Новицкий. – Рига. – 1984. – 260 c.
2.
Голышенков, П.П.
Лекарственные растения и их использование / П.П. Голышенков. – Саранск.
Мордовское книжное издательство, 1990. – 130 c.
3.
Токин, Б.П. Целебные яды
растений / Б.П. Токин – Л.: Наука, 1980. –260 с.
4.
Гортинский, Г.Б.
Целебные растения в комнате / Г.Б. Гортинский, Г.П. Яковлев– М.: Высшая школа,
1993. – С. 98-100.
5.
Козлова, М.А. Влияние
ферментативного гидролизата Хлорофитума хохлатого на печень крыс при
токсическом повреждении. // М.А. Козлова, Д.А. Арешидзе, Ю.Р. Мутыгуллина,
Снисаренко Т.А. // Вестник МГОУ. – М., 2009, №3. – С. 37-41.
6.
Калинская, Н.С.
Особенности физиологической и репаративной регенерации печени крыс в
репродуктивном периоде онтогенеза под влиянием биопрепаратов на основе Каллизии
душистой. Автореф…. дисс. канд. биол. наук / Н.С. Калинская – Ставрополь, 2009.
– 22 с.
7.
Лушников, Е.Ф. Гибель
клетки / Е.Ф. Лушников, А.Ю. Абросимов. – М.: Медицина, 2001. – 160 с.
8.
Хабриев, Р.У.
Фармакологический справочник / Р.У. Хабриев, Р.И. Ягудина, Л.К. Овчинникова. –
М.: Серебряные нити, 2006 – 704 с.
9.
Фильченков, А.А. Апоптоз
и рак / А.А. Фильченков, Р.С. Стойка. – Киев.: МОРИОН, 1999. – 182 с.
10. Logsdon, M.D.
Apoptosis and the Bcl–2 gene family: patterns of expression and prognostic
value in stage I and II follicular center lymphoma? / M.D. Logsdon, R.E. Jr.
Meyn, P.C. Besa // Int J Radiat Oncol Biol Phys – 1999, 44. P. 19-29.