Химия и химические технологии∕2.Теоретическая
химия
Кереселидзе Дж. А., Кучухидзе Т.,
Пачулия З. В.
Тбилисский
государственный университет им. И. Джавахишвили, Грузия
КВАНТОВО-ХИМИЧЕСКОЕ
ИЗУЧЕНИЕ ВЛИЯНИЯ ЗАМЕСТИТЕЛЕЙ НА ТАУТОМЕРНОЕ ПРЕВРАЩЕНИЕ ПРОИЗВОДНЫХ
АЦЕТОФЕНОНА
Таутомерное превращение производных ацетофенона является одной из важнейших
стадией многих химических реакций [1,2]. С целью количественного описания
влияния заместителей на способность таутомерного превращения
квантово-химическим неэмпирическим методом теории функционала плотности (DFT-Density function Theory) [3] были рассчитаны энергии
активации (DE#), константы
таутомерного равновесия (КТ) и заряды на атоме кислорода (qО) производных ацетофенона. Результаты расчётов приведены в таблице 1. Для
переноса протона был использован межмолекулярный механизм таутомерного
превращения [4]:
схема
1
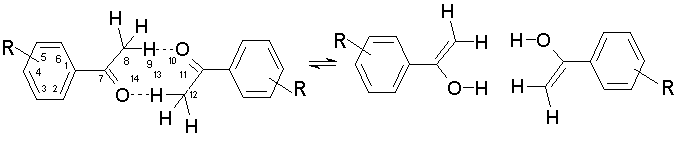 кетонная форма енольная форма
кетонная форма енольная форма
R = H, п-Cl, п-NO2, п-CH3, п-OCH3, п-NH2, м-Cl, м-NO2, м-CH3, м-OCH3, м-NH2.
Для
количественного описания влияния заместителей в пара- и мета- положении
на таутомерное превращение ацетофенона были применены константы заместителей по
Гаммету (sп,м) [5]. В частности, на основании
данных расчётов были построены зависимости энергии активации (DЕ#) (рис.2), зарядов на атоме кислорода (qО) (рис.3) и константы таутомерного равновесия (КТ) (рис.4) от sп,м.
Таблица 1. Энергии активации (DE№),
константы таутомерного равновесия
(КТ), заряды
на атоме кислорода (qО) производных ацетофенона и
константы пара- и мета-заместителей по Гаммету (sp,m)
|
N |
R |
DE#, кДж моль-1 |
КТ |
qO(14) |
sп,м |
|
1 |
H |
109.2 |
0.238 |
-0.505 |
0 |
|
2 |
p-CH3 |
108.4 |
0.238 |
-0.508 |
-0.17 |
|
3 |
p-CH3 |
128.7 |
0.216 |
-0.507 |
-0.07 |
|
4 |
p-OCH3 |
109.6 |
0.257 |
-0.514 |
-0.27 |
|
5 |
m-OCH3 |
136.0 |
0.185 |
-0.512 |
0.11 |
|
6 |
p-NH2 |
105.4 |
0.290 |
-0.520 |
-0.66 |
|
7 |
m-NH2 |
110.2 |
0.190 |
-0.505 |
-0.16 |
|
8 |
p-Cl |
109.6 |
0.225 |
-0.505 |
0.23 |
|
9 |
m-CI |
115.5 |
0.180 |
-0.500 |
0.37 |
|
10 |
p-NO2 |
126.8 |
0.217 |
-0.502 |
0.78 |
|
11 |
m-NO2 |
117.2 |
0.184 |
-0.499 |
0.71 |
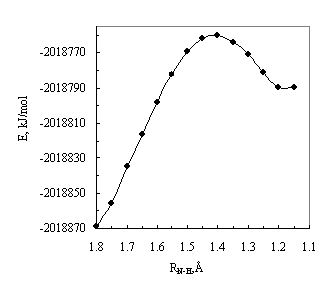
Рис.1. Зависимость полной энергии (Е) незамещённого ацетофенона
(1) от координаты реакции
межмолекулярного переноса протона (RNH).
На рис.1, в качестве примера, приведена энергетическая
диаграма определения энергии активации (DE#) таутомерного превращения незамещённого ацетофенона.Энергия активации
производных ацетофенона симбатно зависит от константы заместителя (рис.2), т.е.
электронодонорные заместители (СН3, ОСН3 и NH2) вызывают уменьшение DE#, а
электроноакцепторные – увеличение.
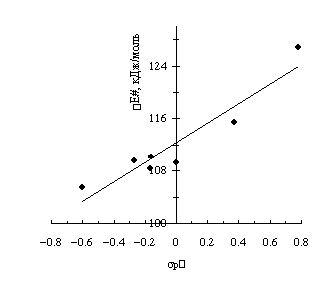
Рис.2.
Зависимость энергии активации (ΔЕ#) таутомерного превращения
производных
ацетофенона от константы заместителя по Гаммету (sp,m).
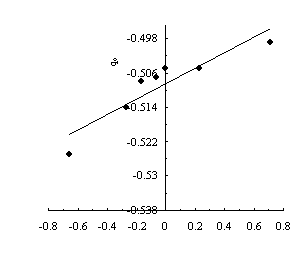
Рис.3. Зависимость заряда на атоме кислорода от s-константы
заместителя по Гаммету.
Такая зависимость объясняется тем, что электронодонорные
заместители увеличивают электронный заряд на кислородном атоме (рис.3) и тем
самым увеличивают протоноакцепторное свойство этого атома, вследствие чего
уменьшаются энергетические затраты для образования енольной формы. Для
электроноакцепторных заместителей наблюдается обратный эффект и поэтому для
переноса протонов требуются высокие энергии. Предложенное объяснение
подтверждается антибатной зависимостью константы таутомерного равновесия (КТ)
от констант заместителей, согласно которой электронодонорные заместители
увеличивают, а электроноакцепторные уменьшают енольную долю производных
ацетофенона (рис. 4).
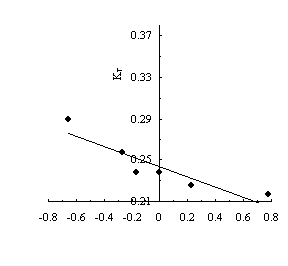
Рис.4. Зависимость константы таутомерного равновесия
производных
ацетофенона (КТ)
от константы заместителя по Гаммету).
Из проведенного анализа квантово-химических расчётов
можно сделать общий вывод, что электронодонорные заместители способствуют
процессу таутомерного превращения, а электроноакцепторные – препятствуют.
Следовательно, энергетические (DE#) и кинетические (КТ) характеристики, рассчитанные
квантово-химическим методом, могут служить для количественного описания влияния
заместителей на таутомерное превращение производных ацетофенона.
Литература:
1. Robinson B. The Fischer Indole Synthesis.
Chem. Rev., 1963, 63, 373-401.
2. Gribble G.W., Resent developments in indole ring synthesis. J. Chem. Soc.,
PerkinTrans. 1, 2000, 1045-1075.
3. Kohn, W., Becke A.D., Parr R.G. Density
Functional theory of Electronic Structure. J. Phys.Chem., 1996, 100,
12974-12980
4. Кереселидзе Дж.А., О механизме
кето-енольной таутомерии ацетофенона.
Ж. физ. Химии, 1998, 72 144-145.
5.
Пальм В.А., Основы количественной теории органических реакции, Химия,
Л., 1967, 356 с.