Химия и
химическая технология/ 6.Органическая химия
К.т.н.
Ю.Ф. Якуба, к. с-х. н. М.В. Захарова,
М.В. Филимонов,
В.В. Шестакова
Государственное научное учреждение
Северо-Кавказский зональный научно-исследовательский институт садоводства и
виноградарства Россельхозакадемии, Россия
Определение глюкозы, сахарозы, фруктозы методом капиллярного электрофореза
На
долю углеводов приходится около 80 % сухого вещества растений и плодов.
Углеводы синтезируются всеми зелеными растениями, изучение компонентного состава
углеводов способствует раскрытию физиолого-биохимических механизмов адаптации
растений к стрессам окружающей среды. Синтез углеводов и их содержание напрямую
связано с урожайностью, потребительским качеством ягод, плодов и винограда.
Аналитическая
информация о компонентном составе сахаров в плодах, винограде и продуктах их
переработки, как правило, ограничивается суммарными показателя, нередко
носящими расчетный характер.
Практикуемые
методы определения сахаров условно можно разделить на две группы – физические и
химические. Среди химических методов анализа широко известны
фотоколориметрические методики количественного определения сахаров: реакция с
пикриновой кислотой (по Крезелиус - Зейферт); с 3,5-динитросалициловой
кислотой; антроновый метод определения сахаров (по Моррису-Роэ), тонкослойной
хроматографии, газовой хроматографии или хроматомасс-спектрометрии,
ферментативного анализа, жидкостной хроматографии и высокоэффективного
капиллярного электрофореза. Весьма перспективными для количественного определения
сахаров представляется разработка и модификация методик с использованием
капиллярного электрофореза, уже востребованного в аналитической практике [1].
Косвенное УФ-детектирование в методике капиллярного
электрофореза использовано для определения концентрации сахаров, а также
примесей в сахаре и образцах вина [2]. Данный прием позволил отказаться от
дериватизации и обеспечить предел обнаружения – 1-10 мг/дм3
испытуемого объекта [3]. Для решения проблемы эффективного разделения сахаров
предложено использовать ведущий электролит с высоким значением рН, получать
производные углеводов с помощью реагентов [4], молекулы которых содержат
хромофорные ионогенные группы. Изучена возможность лигандообменного
капиллярного электрофореза для определения глюкозы, фруктозы, сахарозы в форме
соответствующих комплексов [5] с катионами двухвалентной меди. Предложены оптимизированные условия
разделения глюкозы, фруктозы, сахарозы в следующих условиях анализа: ведущий
электролит – 175 мМ/дм3 аммиака, 1 мМ/дм3 двухвалентной
меди; дозирование пробы – 10 с, 30 мБар, напряжение +25 кВ, длина волны
детектирования – 245 нм, эффективная длина кварцевого капилляра 0,5 м, внутренний диаметр 75•10-6 м. Предел
обнаружения изучаемых веществ составил 5-21 мг/дм3.
В проведенных исследованиях
для оптимизации разделения и количественного определения массовой концентрации
глюкозы, сахарозы и фруктозы, основывающихся на имеющейся информации, применяли
косвенное детектирование и несколько вариантов ведущего электролита.
В результате оптимизированы следующие условия выполнения анализа:
система
капиллярного электрофореза серии «Капель», оборудованная ультрафиолетовым
детектором, с длиной волны лампы 254 нм, источником питания отрицательного
напряжения и следующими характеристиками:
кварцевый
капилляр, эффективной длиной 0,5 м до детектора, внутренним диаметром 75•10-6
м.
Для эффективного количественного анализа используют раствор ведущего электролита следующего состава: 4 г/дм3 сорбата калия, 8 г/дм3 10% водного раствора цетил-триметил-аммоний-основания (ЦТА-ОН), 36 г/дм3 глицерина, 0,16 г/дм3 гидроокиси калия. Срок хранения ведущего электролита не более суток. Ведущий электролит готовят в количестве, обеспечивающем потребности рабочего дня. Рекомендуемое напряжение –16 кВ, время анализа 20 минут.
Пробоподготовку
жидкой пробы осуществляли следующим образом: сок или вино разбавляли в 2-50 раз
(в зависимости от ожидаемого суммарного содержания сахаров), при необходимости
фильтровали, центрифугировали 3-5 минут при 6000 об-1, переносили в
прибор и производили дозирование пробы пневматическим методом под давлением 30
мБар в течение 5 секунд.
Для определения
сахаров, например, в виноградных листьях, отбрали пробу в количестве 1,00 г,
растирали в ступке при добавлении 9 см3 дистиллированной воды до
гомогенного состояния. Затем массу настаивали в течение 1 часа, фильтровали,
центрифугировали и подвергали анализу.
Ориентировочное
время миграции в предлагаемых условиях анализа: глюкозы – 15,2 мин, сахарозы –
16,2 мин, фруктозы – 14,5 мин. Диапазон измеряемых значений массовых
концентраций сахаров составил 0,1-5,0 г/дм3.
Калибровочные
растворы концентраций 0,1, 0,5, 1, 2, 5 г/дм3 готовили на
дистиллированной воде из химически чистых препаратов глюкозы, фруктозы,
сахарозы. Растворы устойчивы в течение двух суток при комнатной температуре.
Пример
определения модельной смеси сахаров в оптимальных условиях анализа, показан на
рис.
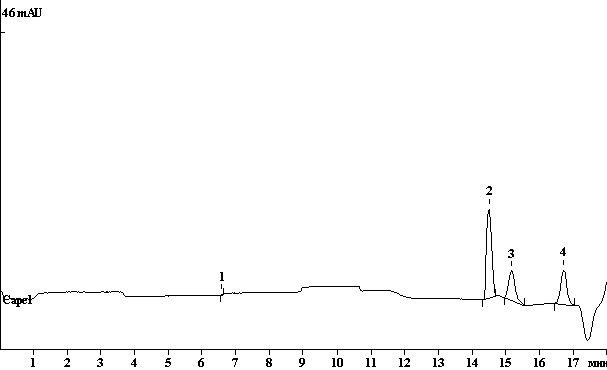
Рисунок –
Электрофореграмма модельной смеси сахаров; 2 – фруктоза, 3 – глюкоза, 4 –
сахароза
В разработанных
условиях методики проведен анализ градуировочных смесей, фруктовых соков,
полусухих и полусладких красных и белых виноградных вин, экстрактов
вегетативных органов растений, табл.
Таблица –
Определение глюкозы, сахарозы, фруктозы в исследуемых объектах, г/кг
|
Исследуемый объект |
Компонент |
||
|
Глюкоза |
Сахароза |
Фруктоза |
|
|
Яблочный сок |
12,6 |
17,5 |
81 |
|
Арбузный сок |
23,8 |
13,0 |
38,4 |
|
Пчелиный мед |
370 |
0 |
350 |
|
Полусухое виноградное вино |
15,5 |
0 |
15,9 |
|
Виноградный лист |
4,6 |
5,1 |
4,4 |
Предлагаемая
методика с использованием капиллярного электрофореза обеспечивает экспрессность
и объективность определения сахаров в сложных по составу биологических пробах.
Установлено, что количественному определению не мешают фенольные соединения,
аминокислоты, анионы, органические кислоты, глицерин и изомеры бутиленгликоля.
Литература
1.Kvasnicka F. // J. Sep. Sci. –
2005. – V.28. - P. 813-825.
2.O’Flanerty B., Yang W.P., Sengupta S., Cholli A.L. // Ass. AVH – 7 Symposium.
- Reims, 2000. - P. 22.
3.Lu B., Westerlund D. // Electropforesis. – 1996. - № 17. – P. 325.
4.Lee Y. Lin T.-I. // J. Chromatogr.
B. – 1996. – № 681. – P. 87.
5.Алексеева А.В., Карцова
Л.А., Казачищева Н.В. // Ж. Аналитической химии. - 2010. - Т.65. - №2. - С.
205-211.
Сведения об авторах
|
Ф.И.О. |
Якуба Юрий Федорович Захарова Марина Витальевна Филимонов Михаил
Васильевич Шестакова Вера
Владимировна |
|
Название
статьи |
Определение глюкозы, сахарозы, фруктозы методом капиллярного электрофореза |
|
Рубрика |
С/х науки |
|
Телефон |
+7-861-2525877
(факс) |
|
e.mail |
|
|
Адрес |
Государственное научное учреждение Северо-Кавказский зональный научно-исследовательский институт садоводства и виноградарства Россельхозакадемии, РФ, г. Краснодар, ул. 40-лет Победы 39 |
|
Индекс |
350901 |
Переписку вести с Якубой Ю.Ф.