Химия и химические технологии/6. Органическая
химия
Д.х.н., профессор Геворкян А. А.,
д.х.н. Аракелян А.С.
Количественная оценка жесткости и
мягкости кислот и оснований (ЖМКО) в единицах заряда
Центр органической и фармхимии НАН
Армении, Армения.
Концепция Р. Пирсона о ЖМКО, хотя
построена на качественных наблюдениях [1], широко применяется в современной
химии. Причина одна: её (концепцию) можно приложить ко всем атомам молекул, во
всех их взаимодействиях и реакциях, особенно после того, как мы смогли качественные
характеристики атомов заменить количественными признаками в единицах заряда
[6-9,12]. Мы столкнулись с этой проблемой при поиске катализаторов с целью ими заменить
эфират трифторида бора в реакции изомеризации элоксида 1 в бромокетон 2 (Схема 1
[2]).
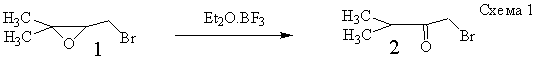
Оказалось, эту роль может
играть, кроме серной кислоты, также хлорсульфоновая кислота, которая как кислота
Полинга [3-5], гораздо слабей, чем серная. Это притом, что согласно классической
теории по кислотной функции Гаммета Но хлорсульфоновая
превосходит серную кислоту (12.8 против 12.1, Схема 2) [3].

Однако сомнения возникли также относительно
пригодности этого (Но) признака в качестве меры оценки каталитической
активности молекул. Они возникли потому, что обнаружились вопросы, на которые
ответить было невозможно. Действительно, как могут столь разные по силе кислоты, как бензол-
и толуолсулфокислоты, иметь одни и те же характеристики диссоциации (по 0.7
каждая)? Никак (Схема 3). Невозможно также ответить на вопрос: это ошибка
эксперимента или – опечатка [4]?

Этот ряд противоречивых
фактов привел нас к выводу о том, что
зарядная теория химии, помимо теоретической, приобретает также практическую
ценность[5-9]. Во-первых, позволяет ответить на приведенные выше вопросы почти
моментально (в считанные минуты). Во-вторых, позволяет обнаружить
закономерности, согласно которым каталитическая активность, имеет совершенно
другую причину. Об этом говорит тот факт, что изомеризацию бромида 1 вызывает
как серная и хлорсульфоновая кислоты, так и п-толуолсульфоновая, зарядные силы
которых гораздо ниже, чем у серной кислоты. Ценность подхода также в том, что в
подозрительных случаях их можно пересчитать, а при необходимости, проверить и
уточнить экспериментом. Тем более, что химический путь проверки не столь
трудоемкий и сложный, как определение функции кислотности (выбор концентрации,
индикаторов и т.д.).
Другое доказательство сомнительности известных методов – определение (и уточнение
справочных данных [5]) кислотности пропионовой и масляной кислот химическим методом
(Схема 3).
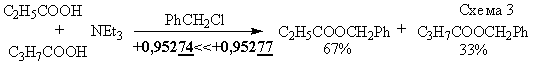
Причина возникновения противоречия
– в откровенно ошибочном выборе метода
оценки химических свойств молекул. Это оценка кислотных свойств атомов
гидроксильной группы физическим методом
(вновь как бы «длину» «измеряли» граммами) [7-9].
Между тем, если бы химики характеристики атомов оценили их
реакционной способностью, как это сделал автор [5], противоречия исключались бы
сами собой (Табл. 1).
Иначе говоря, произошло бы предпочтительное образование именно
пропионата, а не бутирата бензилового спирта (Табл. 1 и соотношение 67:33, что
соответствует порогам зарядов этих
кислот: +0,95274 << +0,95277). Именно благодаря тому, что гидроксильный
атом водорода серной кислоты имеет
больший положительный заряд (+1.05 p), чем хлорсульфоновая кислота
(+1,0265 p), обнаруживает малую каталитическую активность.
 По той
же причине более высокая каталитическая активность хлорсульфоновой кислоты обусловлена
тем, что зарядный порог реакции противоиона её водорода наступает раньше порога
противоиона серной кислоты (-1.05 >> -1,0265 p). Это значит, что пора понять
всему мировому химическому сообществу, что атомы молекул ПОНИМАЮТ ТОЛЬКО ОДИН «ЯЗЫК». Это язык зарядов
атомов, который их наделила сама Природа
[6-9,12].
По той
же причине более высокая каталитическая активность хлорсульфоновой кислоты обусловлена
тем, что зарядный порог реакции противоиона её водорода наступает раньше порога
противоиона серной кислоты (-1.05 >> -1,0265 p). Это значит, что пора понять
всему мировому химическому сообществу, что атомы молекул ПОНИМАЮТ ТОЛЬКО ОДИН «ЯЗЫК». Это язык зарядов
атомов, который их наделила сама Природа
[6-9,12].
Иначе придется химикам всех стран и народов согласиться с
грубейшими ошибками справочников и учебных пособий по химии, согласно которым,
якобы п-MeC6H4SO2OH (2.10-1) является
более сильной кислотой, чем п-BrC6H4SO2OH
(1.1.10-4) [4,10,11]! Так стало очевидно, что доверять характеристикам
свойств атомов, полученными НЕ
химическими методами, чревато грубейшими ошибками. Следовательно, необходимо заменить её более точным методом оценки кислотных свойств
атомов молекул. Это оценка свойств атомов в единицах заряда (в полингах). Обусловлено
это тем, что, во-первых, его оценочные значения зарядов совпадают с
оценками зарядов атомов лучшим инструментальным методом (Рис. 1). Во-вторых,
эти предсказания применимы как для оценки химических, так и физических и
биологических свойств молекул.

В-третьих, подход оценки зарядов,
в отличие от общепринятой теории не имеет и не признает каких-либо ИСКЛЮЧЕНИЙ [6-9].
Действительно, какой другой метод предсказания свойств молекул
в состоянии обнаружить такое количество неточностей и доказать их достоверность
десятками и сотнями фактов эксперимента, с первой же попытки? Отвечаем: на
современном этапе развития химии, предлагаемый подход – ЕДИНСТВЕННЫЙ.
Это значит также (И САМОЕ
ГЛАВНОЕ), что принятие или
непринятие этой теории, от воли человека (химика или физика) НЕ ЗАВИСИТ. Рано или поздно она будет признана в своих
«законных» правах. Тем более, что теми же зарядами контролируются также
физические и биологические свойства молекул [6-9]. Более того, в отличие от
зарядной теории [6-9], «современная», с
одной стороны утверждает, что жесткость кислоты растет параллельно величине
положительного заряда, а с другой – считает [1,11], что она анти параллельна
величине радиуса атома кислоты Пирсона: вновь пренебрегает тем неоспоримым фактом, что величина
заряда атома определяется величиной заряда его противоиона. Соответственно допускает, что противоион метильной группы
является более жесткой кислотой, чем этильной или другой алкильной группы, что противоречит всем, без единого
исключения, показаниям эксперимента [5-7]. А без оценки сродства атомов молекул
в единицах заряда, проводить целенаправленный синтез, тем более, конкурировать
с учеными, владеющими такими знаниями, практически невозможно (исключается безоговорочно!)
[6-9,12].
Литература
1. Басоло Ф. Пирсон Р., Механизмы неорганических реакций. «Мир», М. 1971.
2.
Казарян
П. И., Авакян С. В., Геворкян А. А., Арм. хим. ж., 1984, 801.
3.
Реутов
О.А., Курц А. П., Бутин К. П., Органическая химия, часть 1, Бином, 2005, 244.
4.
Справочник
химика. Изд. «Химия», Т. 3. М.-Л., 1964, 94.
5. Петросян К. А. Хим. ж. Армении, 2006, 59, No 3, 134-136.
6.
Геворкян
А. А. Кислоты и основания Полинга. Хим.
ж. Армении, 2007, 50, No 4, 713-730.
7.
Геворкян
А.А. Вестник Академии медико-технических наук РФ. 2009 No 1(2), 71-75.
8.
Геворкян
А. А. "Обобщенная теория кислот и
оснований. Новое воззрение на реакционную способность атомов и молекул".
Изд. Наука, Ереван, 2006 г. 158 с.
9.
Геворкян
А. А., Аракелян А.С., Nauka I Inowscja. (Наука и инновации), Volume 14, 52-54, Przemysl, Nauka I studia, Poland, 2011.
10.
Общая органическая химия, том 4, Химия, М., 1983. 42.
11.
Беккер
Г. Введение в электронную теорию органических реакций. М.: Мир, 1977.
12. Геворкян А.А., Аракелян А.С., Джанджулян Ж. Л., Микаелян А. Р.,
Петросян К. А., Паносян Г. А. ЖОрХ,
2005, 41, No 1, 134.