Голубцов В.В., Кулич
Е.Н.
МБУЗ ГБ № 2
«КМЛДО», г.Краснодар
Интраоперационная оценка
кровосберегающих технологий
В настоящее время в связи с развитием
современных хирургических технологий, расширением объема оперативных
вмешательств на органах брюшной полости, одной из важных проблем является
снижение интраоперационной кровопотери [1]. В условиях операционного
хирургического стресса кровопотеря может стать причиной возникновения многих
патологических состояний, связанных с потерей переносчиков кислорода, факторов
свертывания, генерализованной гипоперфузией тканей. Восполнение кровопотери с
максимальным сохранением гомеостаза является одной из насущных и непростых
проблем как для анестезиологии-реаниматологии, так и для хирургии [2,3,4,6,7].
Учитывая тенденции к
расширению объема хирургических вмешательств на органах брюшной полости,
включающих пластику и реконструкцию магистральных сосудов, стандартные варианты
и схемы инфузионно-трансфузионной терапии становятся не достаточно эффективными
для поддержания адекватного гомеостаза. Однако, хирургические методы не всегда
соответствуют современной доктрине «бескровной» хирургии. Поиск и внедрение
новых технологий, направленных на минимизацию операционной кровопотери являются
крайне востребованными [5,7].
Целью данного исследования является сравнение методов коррекции кровопотери
с использованием острой аппаратной реинфузией отмытых эритроцитов с гипер- и
нормоволемической гемодилюцией.
Материал и методы
В рамках исследования был проведен
ретроспективный анализ 53 наркозных карт, пациентов, подвергшихся оперативным
вмешательствам на органах брюшной полости по поводу местнораспространенных
онкологических процессов. Ход оперативного вмешательства предполагал
реконструкцию магистральных сосудов брюшной полости. Все пациенты были
разделены на две группы: 1 группа - основная (n=28) и 2 группа контроля (n=25). В основной группе перед началом операции всем
пациентам производилась эксфузия 400-800 мл крови, возмещаемая раствором
гидроксиэтилкрахмала 130/0,4 (ГЭК) в соотношении 1:1. В группе контроля
использовался 0,9% р-р хлорида натрия в соотношении 1:1,5.
Во время операции в основной группе
производилась аппаратная реинфузия аутоэритроцитов с использованием систем Fresenius C.A.T.S., Haemonetic
Cell Saver 5 и
5+. В группе сравнения использовались фильтрационные системы OrthoPAT, Redax
и HandyVAC. Учитывая онкологическую патологию, в обоих группах
полученную эритроцитарную взвесь дополнительно фильтровали антилейкоцитарными системами
Pull.
Длительность оперативного вмешательства
колебалась от 6 до 8 часов. Всем пациентам проводилась тотальная внутривенная
анестезия на основе кетамина.
Критериями исключения из исследования
являлись: тяжелые декомпенсированные соматические заболевания, представляющие
постоянную угрозу жизни, риск анестезии класса IV-V по ASA.
У всех пациентов регистрировались общие и
антропометрические данные. Оценивались показатели агрегатного состояния, биохимического
и общего анализа венозной крови. Запись электрокоагулограммы (ЭЛКГ)
производилась на приборе «Электрокоагулограф Н-334».
Статистические
методы исследования. Производили
вычисление медианы (Ме) и персентиля (Р25, Р75). Достоверность
различий полученных результатов проводилась с использованием непараметрических
методов статистики (Крускала-Уоллиса и Хи-квадрат).
Результаты и их обсуждение
Одним
из важнейших критериев оценки пациентов с кровотечением, или
постгеморрагическом состоянии, является определение показателей гемограммы.
Безусловно, особенно в случае развития острой массивной кровопотери, истинный
значения анализа крови проявятся лишь через 24-48 ч. Однако динамическая оценка
имеет большое клиническое значение. Так, при анализе содержания гемоглобина,
были полученные следующие результаты (рис. 1).
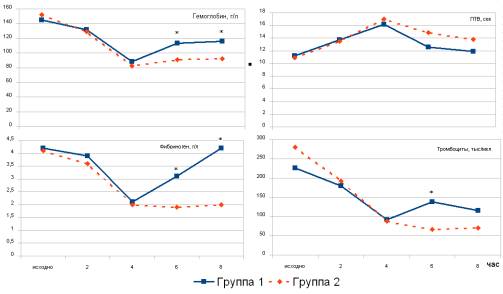
Рис.1. Динамика исследуемых показателей на этапах
операции
* - Р < 0,05 (по критерию Крускала-Уолиса)
Максимальные нарушения гомеостаза
наблюдались к четвертому часу оперативного вмешательства, когда суммарный объем
кровопотери достигал одного (и более) объема циркулирующей крови.
На рисунке, отражающем динамику
концентрации гемоглобина можно увидеть, что к четвертому часу операции в обеих
группах возникали показания для начала коррекции, однако к шестому часу
операции, и далее, уровень гемоглобина в группе 1 был достоверно выше, нежели в
группе 2, что также относится и к этапу окончания операции (р<0,05).
Что касается состояния системы гемостаза,
то из определяемых лабораторным путем показателей, наиболее информативно
отреагировал фибриноген (Рис. 1).
Так к моменту выполнения основного этапа
операции, можно проследить достоверные различия в его концентрации, между
группами сравнения. Хотя в ходе проводимой коррекции, критического снижения фибриногена, характерного для массивной
кровопотери, мы не получали.
Напротив, общепризнанный тест – протромбиновое
время (ПТВ), оказался малоинформативным, что с другой стороны говорит о
достаточно полноценном протезировании внешнего пути коагуляции, в ходе
анестезии (рис. 1).
Не столь существенные различия были
получены и при оценке тромбоцитарного гемостаза (рис. 1). Мы не усмотрели связи
в развитии тромбоцитопении и использовании различных систем для реинфузии.
Анализ такого параметра
электрокоагулограммы, как Ао, характеризующего плотность образующегося сгустка,
показал наличие у многих пациентов контрольной группы, рыхлого сгустка,
образующегося вследствие активации фибринолитической системы (которая в свою очередь отображается
интегральным параметром электрокоагулограммы – фибринолитическим потенциалом).
Однако, не смотря на фибринолитическую активацию, уровень коагуляционной
активности у пациентов данной группы был незначительно повышен (рис. 2).
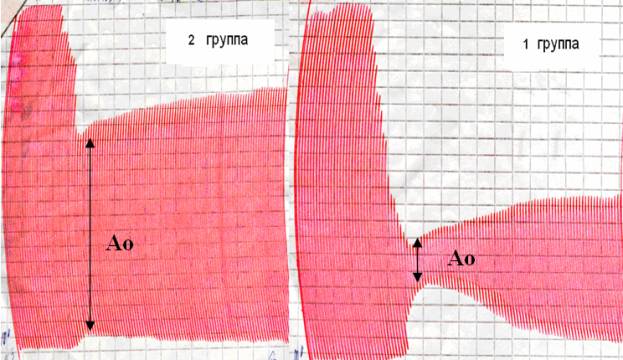
Рис. 2. Клинический пример формирования рыхлого
сгустка у пациентов 2 группы (по данным ЭЛГК)
Выявленное с помощью электрокоагулограмы
формирование рыхлого сгустка у пациентов 2 группы говорит о чрезмерной
активации фибринолиза, что является признаком развивающейся коагулопатии. О
компенсированном состоянии системы гемостаза можно говорить только в случае
формирования гемостатически полноценного сгустка, что наблюдалось у 55% больных
данной подгруппы. Развитие фибринолитического варианта ДВС-синдрома отмечалось
в 32,7%. Других вариантов развития ДВС мы не встречали.
Как видно из данной иллюстрации,
практически отсутствуют коагуляционные нарушения, вместе с тем состояние
гемостаза можно расценить как неустойчивое, потребовавшее назначения препаратов
апротинина в группе 2. В группе сравнения, напротив не применялись
антифибринолитики, и состояние гемостаза носило компенсированный характер.
В целом, метод ЭЛКГ можно считать
достаточно информативным для оценки плотности формирующегося сгустка и
состояния фибринолиза.
Однако, коррекция свежезамороженной
плазмой, примененная в обеих группах, существенно не различалась (рис. 3).
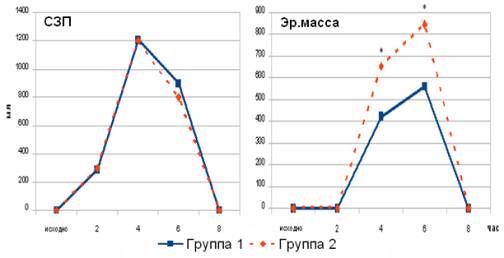
Рис. 3. Потребность в компонентах крови
* - Р < 0,05 (по критерию Крускала-Уолиса)
Используя СЗП, только по одному критерию –
развитие коагулопатии, мы практически исключили ее применение на начальных
этапах вмешательства и после удаления хирургического препарата, что существенно
повлияло на количество расходуемых интраоперационно гемотрансфузионных сред.
В то же время у пациентов, в
дооперационной подготовке которых выполнялась гемодилюция с использованием ГЭК
130/0,4, количество перелитых аллогенных эритроцитов было существенно ниже
(рис. 3).
Итогом исследования послужил 24 часовой
рубеж, на котором были проведены контрольные определения тяжести состояния, с
последующей оценкой 30 дневной летальности (табл. 1).
Таблица 1.
Сравнительная оценка тяжести состояния и летальности
|
Группа |
n |
Кровопотеря,
мл Ме (р25/р75) |
АРАСНЕ
III, Ме (р25/р75) |
30-ти
дневная летальность, % |
|
1 |
20 |
7600 (6100/8050) |
62 (54/66) |
18.8 |
|
2 |
22 |
7400 (6700/8000) |
95 (90/102)* |
33.0* |
|
*-
Р≤ 0,05 по критерию Хи- квадрат |
||||
Объем кровопотери в обеих группах
достоверно не отличался, но тяжесть состояния, оцениваемая по шкале АРАСНЕ III и показатель послеоперационной летальности в группе 2
были достоверно выше, чем в группе 1.
Выводы
1. Аппаратная реинфузия является надежным способом коррекции
анемии у пациентов с массивной и сверхмассивной кровопотерей.
2. Совместное применение методик гипер- или нормоволемической
гемодилюции и реинфузии имеет больший эффект на коррекцию гомеостаза, нежели
изолированное применение любой из этих методик.
3. Использование гемодинамических кровезаменителей на
основе ГЭК 130/0,4 при выполнении кровосберегающих технологий, оказывает
меньшее влияние на процессы коагуляции и фибринолиза, что выражается в
уменьшении использования аллогенных компонентов крови, а в сочетании с
аппаратной реинфузией эритроцитов – улучшает результаты лечения.
Литература:
1.
Интенсивная терапия // Под ред. Гельфанд Б.Р., Салтанов А.И. - М.:ГЭОТАР Медиа, 2009.- 1784 с.
2.
Жибурт Е.Б.
Правила переливания плазмы - М.: «Медицина», 2008.- 240 с.
3.
Мазуркевич
Г.С., Багненко С.Ф. Шок.- С.Пб.: Политехника, 2004.- 539 с.
4.
Морган Д., Михаил М.С. Клиническая
анестезиология: Монография.- М.-СПб.:БИНОМ-Невский диалект, 2002.- 366 с.
5.
Fink M.P. Reactive oxygen species as mediators of
organ dysfunction caused by sepsis, acute respiratory distress syndrome, or
hemorrhagic shock: potential benefits of resuscitation with Ringer's ethyl
pyruvate solution // Curr Opin Clin Nutr Metab Care.- 2002.- Vol. 5.-
P.167-174.
6.
Kor D.J., Stubbs J.R., Gajic O. Perioperative coagulation management -
fresh frozen plasma // Best Pract Res Clin Anaesthesiol.- 2010.- Vol. 24.- № 1.- Р.51-64.
7.
Stainsby D., MacLennan
S., Hamilton P.
Management of massive blood loss: a template guideline // British Journal of
Anaesthesia.- 2000.-
Vol. 85.- №.
3.- Р. 487-491.