Ветеринария / 1.
д.в.н., проф.
Анников В.В.1, к.в.н. Краснова Е.С.1, д.т.н., проф.,
член-корреспондент РАЕ Родионов И.В.2, студ. Васильева В.С.1
1ФГОУ ВПО «Саратовский государственный аграрный университет имени Н.И.
Вавилова», Россия
2ФГБОУ ВПО
«Саратовский государственный технический университет имени Гагарина Ю.А.», Россия
Статья подготовлена при
поддержке гранта Президента РФ
МК-1799.2011.8.
Оценка влияния термомодифицированных остеофиксаторов
с металлооксидным покрытием, содержащим лантан, на органы иммунной системы
организма экспериментальных животных
Введение
Имплантационные
материалы и покрытия
должны обладать такими биомедицинскими качествами как биоинертность
(нетоксичность), коррозионная стойкость в биосредах, отсутствие
терратогенности. При условии сходства химического состава биосовместимого
материала с химическим составом материальной части костного остова, наличии
микропористости и морфологической гетерогенности поверхности имплантационного
материала, а также при воздействии умеренных функциональных нагрузок на
имплантат и костную ткань, могут протекать высокоэффективные
остеоинтеграционные процессы с формированием прочной взаимосвязи в системе
«имплантат – окружающая кость» (Родионов И.В., 2007; Анников В.В., Фролова
О.Н., 2008).
Наиболее эффективными металлическими материалами медицинских имплантатов типа стержневых и спицевых остеофиксаторов в травматологии и ортопедии являются нержавеющие хромоникелевые стали, обладающие требуемым комплексом физико-химических и механических свойств. Полимерные органические и неорганические материалы не обладают комплексом механических свойств, поэтому не используются для изготовления остеофиксаторов, за исключением углеродного композита, применяемого для некоторых видов имплантатов при остеосинтезе.
Клиническое использование остеофиксаторов с остеоинтеграционными металлооксидными покрытиями позволяет существенно улучшить приживляемость и повысить прочность закрепления изделий в кости.
Термическое
модифицирование остеофиксаторов из нержавеющей стали 12Х18Н9Т методом
оксидирования в воздушной атмосфере является наиболее простым технологическим
процессом получения защитных покрытий с качествами биосовместимости, т.к. не
требует использования специальных газовых сред, сложного и дорогостоящего
оборудования, а также применения особых физико-технических условий для
проведения обработки.
Одним из путей повышения
биомедицинских качеств термооксидированных остеофиксаторов является введение в
химический состав покрытий элементов с бактерицидной активностью. Одним из
таких элементов является лантан, благодаря природным свойствам которого
существенно замедляется развитие патогенных микроорганизмов имплантационной
зоны в наиболее опасный начальный постоперационный период. Это сокращает до
минимума опасность появления воспалительных процессов на более поздних стадиях
имплантации (Родионов И.В., Бутовский К.Г., 2007, 2011). Однако остается
малоизученным влияние термомодифицированных стальных остеофиксаторов с
металлооксидным покрытием, содержащим лантан, на органы иммунной системы.
Поэтому цель работы заключается в исследовании влияния
лантансодержащих металлооксидных покрытий остеофиксаторов из стали 12Х18Н9Т на органы иммунной системы экспериментальных
животных.
Объект,
материалы и методы исследования
Исследования проводились с использованием 12 кроликов
породы «серый великан» и «черный великан» в возрасте шести месяцев с живой
массой 4,5 кг, а также с использованием 10 больных животных (семи собак, трех
кошек), у которых были переломы различных сегментов конечностей. Животные были
сформированы в экспериментальные группы по принципу аналогов.
Объектом исследования являлись остеофиксаторы из
медицинской биотолерантной стали 12Х18Н9Т (ГОСТ 5632-72), на поверхности
которых были получены воздушно-термические металлооксидные покрытия,
электрохимически модифицированные микрочастицами лантана. Контрольной серией
образцов являлись термооксидированные остеофиксаторы, не содержащие в структуре
поверхности лантан.
Материалы для исследования представляли следующие
экспериментальные объекты: кровь, рентгенограммы, красный костный мозг,
селезенка, регионарные лимфатические узлы, бедренные кости.
Всем экспериментальным животным под нейролептаналгезией
выполнялся флексионный перелом бедренной кости и на отломках устанавливался аппарат
внешней чрескостной фиксации.
Постоперационная терапия включала введение цефазолина в
терапевтических дозах и санацию зоны контакта остеофиксаторов с кожей 3%-м
раствором перекиси водорода. Нейролептаналгезия выполнялась раствором ксилы и
1,25%-м раствором золетила. Операционное поле готовилось по Филончикову.
В ходе клинического исследования ежедневно осуществлялось
наблюдение за экспериментальными животными.
Гематологические и иммунологические показатели
определялись до оперативного вмешательства, а также на 3-и, 14-е и 30-е сутки
эксперимента. Гематологические исследования стабилизированной крови проводились
на аппарате «Hema-Screen – 7» с использованием
лизирующего раствора и комплекта реагентов «Юни-гем» для гематологических анализаторов.
Рентгенографическое исследование правых бедренных костей
в боковой и прямой (сагиттальной) проекциях осуществлялось трижды – на 3-и,
14-е, 30-е сутки эксперимента.
Патоморфологическое, цитологическое и гистологическое
исследования проводились на 30-е сутки, когда животных выводили из
эксперимента. Для исследования иммунологического состояния и оценки
эффективности применения остеофиксаторов с термооксидным покрытием, обогащенным
лантаном, у экспериментальных животных определялся уровень Т- и В- лимфоцитов в
периферической крови, проводились исследования бактерицидной и фагоцитарной
активности, осуществлялся НСТ-тест.
Патоморфологическое
исследование проводилось
для оценки качества формирования костного регенерата и визуализации перелома в
области средней трети диафиза бедренных костей в ходе эксперимента.
Для цитологического
исследования бедренная кость освобождалась от мышечной ткани, вскрывался
костномозговой канал и шприцом аспирировался из него костный мозг. Затем
несколько его капель наносилось на предметное стекло и готовились мазки (по
пять мазков от каждого животного). Мазки высушивались на воздухе, потом
фиксировались в течение 30 минут в этиловом спирте, после чего окрашивались
гематоксилином-эозином. Окрашенные мазки исследовались под микроскопом при
увеличении в 1350 крат. Отбор проб для проведения данного исследования
проводился путем препарирования кожи и мышц анатомическим пинцетом и
скальпелем. Таким образом, отбирались лимфоидные органы (селезенка, регионарные
лимфатические узлы), которые после извлечения помещались в фиксирующий раствор
(10%-й водный нейтральный раствор формалина). Из фиксированного биоматериала на
замораживающем микротоме модели 2515 (Reichert Wien) готовились гистосрезы толщиной
15 мкм. Затем с целью изучения их
окрашивали гематоксилином Эрлиха и эозином. Приготовленные таким образом гистологические срезы исследовались
при увеличении 1050,1150 и 1300 крат.
Результаты исследования и их анализ
В первые дни после операции в клиническом состоянии
животных всех групп (опытной и контрольной) не было выявлено существенных отличий.
К седьмым суткам эксперимента при локальном обследовании травмированных конечностей
животных симптомы воспаления мягких тканей не наблюдались, пальпация тканей в
зоне дефекта вызывала незначительное беспокойство животных. К 30 суткам
эксперимента при клиническом исследовании отмечалось удовлетворительное
состояние у всех экспериментальных животных.
При анализе рентгеновских снимков к 30 суткам поле
остеосинтеза в зоне перелома отмечался полный контакт костных фрагментов, их сращение и выраженное формирование эндостальной
костной мозоли у животных всех групп. При этом на рентгенограммах кроликов
контрольной группы отмечалась значительная периостальная реакция в виде наслоения
вокруг термооксидированных остеофиксаторов, введенных в метафизарные зоны бедренной
кости.
Динамика гематологических
показателей свидетельствует о сохраняющихся воспалительных явлениях у
травматически больных животных даже через месяц после проведения операции, что
подчеркивает степень влияния костной травмы на организм (рис. 1). Однако
колебания обсуждаемых показателей в рамках референтных величин свидетельствуют,
в том числе, и о малой инвазивности метода фиксации. Кроме того, нормализация
гематологических показателей у кроликов опытной группы свидетельствует об
отсутствии угнетения гемопоэза при действии лантана, входящего в химический
состав термооксидных покрытий остеофиксаторов.
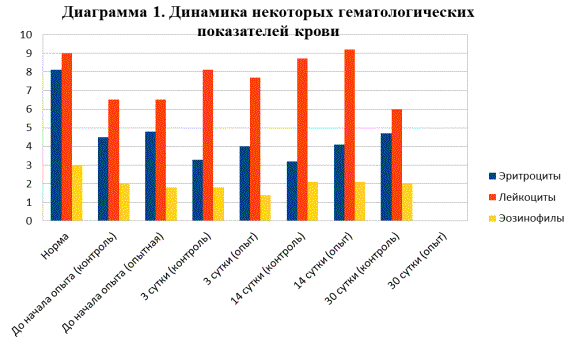
Рис. 1. Результаты
исследования гематологических показателей крови
В процессе исследований проводился подсчет
относительного и абсолютного количества Т- и В- лимфоцитов и их популяций в
периферической крови (табл. 1).
Таблица 1
Динамика иммунологических
показателей (n=6, M±m, *- р≤
0,1, ** - р≤0,05)
|
Показатели, ед.
измерения |
Первая
(контрольная) группа |
Вторая (опытная)
группа |
||||||
|
До операции |
3 сутки после операции |
14 сутки после
операции |
30 сутки после операции |
До операции |
3 сутки после
операции |
14 сутки после
операции |
30 сутки после
операции |
|
|
Т-лимфоциты,% |
67,8± 2,4 |
- |
45,7± 3,3** |
41,1± 1,9** |
42,8± 3,8** |
68,7± 1,8 |
42,8± 2,9** |
36,7± 1,6** |
|
Т-лимфоциты, 109/л |
1,5 |
- |
0,8 |
0,7 |
0,4 |
0,7 |
0,7 |
0,6 |
|
В-лимфоциты, % |
4,0± 0,2 |
- |
2,4± 0,1** |
1,9± 0,3** |
3,5± 0,3** |
4,3± 0,1** |
2,4± 0,3** |
2,0± 0,2** |
|
В-лимфоциты, 109/л |
0,05 |
- |
0,04 |
0,03 |
0,03 |
0,03 |
0,04 |
0,03 |
К 30-м суткам после оперативного вмешательства
относительное содержание Т-лимфоцитов продолжало снижаться до 42,8% в опытной и
контрольной группах по отношению к исходным данным (45,7% в контрольной группе
и 68,7% в опытной группе). Абсолютное их содержание снизилось в
два раза и составило
0,4×109/л в контрольной группе и 0,5×109/л
в опытной группе (1,5×109/л и 0,7×109/л
соответственно). Что касается изменений со стороны В-звена иммунитета, то
колебания в относительных величинах были незначительные и составили 3,5% в контрольной группе и 3,3%
в опытной группе. При этом абсолютное содержание выразилось соответственно
значениями 0,03 и 0,04×109/л.
Таким образом, на
протяжении тридцати суток после остеосинтеза у экспериментальных животных обеих
групп отмечалось постепенное снижение Т- и В-лимфоцитов как в абсолютных, так и
в относительных величинах по отношению к исходному уровню, что свидетельствует
о незначительном угнетении клеточного звена иммунитета. Это свидетельствует об
отсутствии токсического влияния микрочастиц лантана в составе термооксидных
покрытий остеофиксаторов на иммунопоэз.
Изучение показателей фагоцитоза имеет значение для
комплексного анализа иммунодефицитных состояний, порой приводящих к
послеоперационным осложнениям, длительно не заживающим ранам и часто
рецидивирующим гнойным воспалительным процессам (рис. 2).
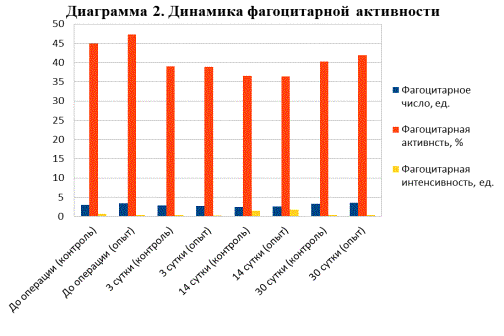
Рис. 2. Результаты исследования динамики фагоцитарной
активности
По истечению 30 суток исследование функционального статуса нейтрофилов
показало, что фагоцитарное число вернулось к исходным данным и составило
2,9±0,3 в контрольной группе животных и 3,2±0,3 ед. в опытной группе животных,
фагоцитарная интенсивность была незначительно ниже исходных данных и составила
(0,4±0,01 ед. и 0,3±0,04 ед. соответственно). Что касается фагоцитарной
активности, то она не вернулась к исходным величинам и составила 38,5±1,7% в
контрольной группе и 40,7±1,2% в опытной группе.
Данные показатели
свидетельствуют о снижении активности нейтрофилов вследствие перелома и
активации резистентности животных в постоперационный период. Кроме того,
несущественный сдвиг данных показателей (фагоцитарная активность – 40,7±1,2% к
45,7±1,5%; фагоцитарная интенсивность – 0,3±0,04 ед. к 0,4±0,02 ед.) у животных
опытной группы свидетельствует об отсутствии иммунодепрессивного влияния
покрытий, содержащих лантан.
Были проведены исследования теста восстановления
нитросинего тетразолия в процессе эксперимента.
К тридцатым суткам
эксперимента тест
восстановления нитросинего тетразолия соответствовал исходным данным (53,2±0,5
ед. в контрольной
группе и 47,8±1,7ед. в опытной группе) и составил 50,1±0,7 ед. (Р ≤ 0,5)
и 49,8±0,8 ед.(Р ≤ 0,5).
Исходя из вышеизложенного
можно утверждать, что стальные остеофиксаторы с металлооксидным покрытием,
содержащим лантан, не угнетают метаболическую активность нейтрофильных
гранулоцитов.
При изучении бактерицидной активности установлено, что по
окончании клинического эксперимента бактериальная активность у животных выражалась
следующими цифрами: 44,0±0,9% в контрольной группе и 54,2±2,4% в опытной группе
(Р≤0,5). Полученные показатели были незначительно ниже исходных величин (60,3±4,5% и 58,8±3,5% соответственно контрольной и опытной
групп).
Таким образом, в результате исследований
отмечалось снижение показателей бактерицидной активности к третьим суткам после
проведения остеосинтеза вследствие угнетения резистентности травматологически
больных животных. К 30-м суткам бактерицидная активность сыворотки крови
увеличивалась, но была ниже исходных показателей у всех животных. При этом
заметной разницы по группам не наблюдалось.
При
морфологическом исследовании бедренной кости животных через 30 суток после
установки аппаратов внешней фиксации с термооксидированными остеофиксаторами,
содержащими в составе поверхности лантан, были получены следующие результаты.
На макропрепаратах бедренных костей кроликов различных групп существенной разницы выявлено не было. Мышцы над местом перелома были без видимых изменений, эластичные, блестящие, гладкие, красного цвета, снаружи покрыты фасцией. При данном исследовании было отмечено образование ровной структуры кости в опытной группе, что свидетельствует о позитивном влиянии микрочастиц лантана в составе термооксидных покрытий остеофиксаторов.
Бедренная кость освобождалась от
мышечной ткани, вскрывался костномозговой канал и шприцом аспирировался из него
костный мозг. После окрашивания мазков, осуществлялся цитологический анализ мазков красного костного мозга для
изучения его реакции на травму, в данном случае на костную травму (табл. 2).
Таблица 2
Средние показатели костного мозга кроликов
(n=12, M ±m, *р ≤ 0,5; **р ≤ 0,05)
|
Показатель, % |
Контрольная группа |
Опытная группа |
|
|
Миелобласты |
1,5 ± 0,3* |
0,9 ± 0,3 |
|
|
Миелоциты |
8,5 ± 0,6 |
9,0 ± 1,9 |
|
|
Метамиелоциты |
10,3 ± 2,0 |
10,5 ± 2,2 |
|
|
Палочкоядерные нейтрофилы |
7,2 ± 1,2* |
4,8 ± 1,4 |
|
|
Сегментоядерные нейтрофилы |
20,0 ± 0,4 |
20,2 ± 0,5 |
|
|
Эозинофилы |
1,8 ± 0,4* |
1,2 ± 0,2 |
|
|
Моноциты |
2,8 ± 0,3 |
1,8 ± 0,4 |
|
|
Лимфоциты |
12,0 ± 0,5** |
7,5 ± 1,1 |
|
|
Эритробласты |
1,2 ± 0,1 |
0,7 ± 0,2* |
|
|
Нормоциты |
базофилы |
3,2 ± 0,2 |
|
|
полихроматофильные |
18,8 ± 0,7 |
||
|
оксифильные |
2,8 ± 0,3 |
||
|
Индекс лейко/эритро (ИЛЭ) |
1,2 |
1,4 |
|
Согласно данным цитологического анализа в контрольной
группе количество миелобластов составило 1,5±0,6%, в опытной группе – 0,9±0,3%.
Уровень миелоцитов и метамиелоцитов
костного мозга животных опытной группы превышал аналогичные показатели в
контрольной группе незначительно (9,0±1,9% и 10,5±2,2% по сравнению с 8,5±0,6 и
10,3±2,0%) (табл. 2). При этом среднее количество палочкоядерных нейтрофилов
(ПЯН) в контрольной группе составило 7,2±1,2%, в опытной группе эти показатели
были на уровне 4,8±1,4%, а количество сегментоядерных нейтрофилов (СЯН)
составляло 20,0±0,4% и 20,2±0,5% соответственно. Это свидетельствует о том, что
у животных контрольной группы наблюдалось расширение белого ростка крови за
счет ПЯН.
Уровень эозинофилов
и моноцитов отличался незначительно как у животных контрольной группы
(эозинофилы 1,8±0,4%, моноциты 2,8±0,3%), так и у животных опытной группы
(эозинофилы 1,2±0,2%, моноциты 1,8±0,4%). Количество лимфоцитов в контрольной
группе составило 12,0±0,5%, в опытной группе – 7,5±1,1%. Можно утверждать, что
у животных контрольной группы расширение белого ростка крови происходило за
счет лимфоцитов. На уровне полихроматофильных нормоцитов, эритробластов и базофилов
в опытной группе (14,8±0,9%, 0,7±0,2% и 2,0±0,4% соответственно) и в контрольной
группе (18,8±0,7%, 1,2±0,1% и 3,2±0,2% соответственно) было отмечено сужение
красного ростка крови, что свидетельствует о незначительном угнетении гемопоэза
(табл. 2).
Необходимо также принимать во внимание соотношение клеток
красной и белой крови костного мозга (индекс
лейко/эритро (ИЛЭ)),
которое свидетельствует о наличии в организме животных либо воспаления (при
расширении ростка белой крови на уровне ПЯН и СЯН), либо анемии (при расширении
ростка красной крови). В
контрольной группе индекс ИЭЛ составил 1,2, в опытной группе – 1,4 (табл. 2).
Эти изменения свидетельствуют о сохраняющихся несущественных воспалительных
явлениях к 30-м суткам эксперимента в области перелома.
Таким образом, описанные выше изменения свидетельствуют о
незначительных воспалительных явлениях и на 30-е сутки после проведения
внешнего остеосинтеза у экспериментально больных животных. По этой причине
можно говорить об отсутствии токсического действия термооксидных покрытий, содержащих
в своем составе лантан, и предположить о его возможном иммуномодулирующем действии.