К.б.н.
Ковальова О.А., к.б.н. Бездєнєжних Н.А., д.б.н. Кудрявець Ю.Й.
Інститут експериментальної
патології, онкології та радіобіології ім. Р.Є.Кавецького НАН України
ЦИТОГЕНЕТИЧНІ АНОМАЛІЇ, АССОЦІЙОВАНІ З ТУМОРОГЕННИМИ ВЛАСТИВОСТЯМИ КЛОНІВ ЛІНІЇ МКС, ОТРИМАНОЇ
ІЗ СПОНТАННОЇ АДЕНОКАРЦИНОМИ МОЛОЧНОЇ ЗАЛОЗИ ЩУРА
Відомо, що
пухлинні клітини відрізняються підвищеним рівнем цитогенетичної нестабільності,
однак не відомий спектр характеристик дестабілізації хромосомного апарату, який
би характеризував появу або зростання туморогенних властивостей цих клітин. З
цією метою було проведено клонування клітин аденокарциноми молочної залози щура
лінії МКС, що характеризується нестабільністю фенотипу. В результаті були
виділені клони з «епітеліальним» та «мезенхімальним» фенотипом та вивчено їх.
Матеріали та методи.
З клітин
лінії МКС було отримано клони з різними ростовими та морфологічними
характеристиками – епітеліальними і мезенхімальними. Досліджувані клони: клон F11 та
клон Т-5 (клітини з мезенхімальною морфологією) та клон В3F (сублінія,
що складається з суміші клітин епітеліальної та мезенхімальної морфології).
Визначення туморогенності клітин in vitro проводили за допомогою дослідження їх колонієутворюючої здатності в середовищі з
напіврідким агаром. Отримані нами сублінії за їх морфологією та адгезивними
характеристиками при рості на субстраті були розділені на 3 типи: епітеліальні
– з високою адгезивною здатністю («Е»), мезенхімальні – з низькою адгезивною
здатністю («М») та клони зі змішаними морфологією та адгезивними
властивостями («Е+М»)
Клітини для цитогенетичного аналізу готували за стандартною методикою. На
цитогенетичних препаратах були розглянуті наступні характеристики: кількість
мітозів (Мітоз), клітин з передчасною
конденсацією хромосом (ПКХ), клітин з мікроядрами (КМЯ), апоптичних клітин (Апопт), клітин з ядерними протрузіями (Протр) та двоядерних
клітин (ДК), які розраховували на 1000 клітин і виражали в промілях (‰). В
метафазних пластинках враховували розбіжності за числом хромосом, поліплоїдію
та модальне число хромосом. Статистичну достовірність оцінювали за t-критерієм Ст’юдента (tS).
Результати.
При
проведенні тесту на туморогенність клонів in vitro була встановлена суттєва різниця
в % колонієутворення в залежності від типу клітин (Е чи М), що чітко
асоціювалась і з здатністю чи, навпаки, нездатністю певних клітин викликати
пухлини у тварин.
Низька
колонієутворююча здатність клітин епітеліального фенотипу, що є характеристикою
рівня туморогенності in vitro, асоціюється з нездатністю даних клітин викликати
пухлини у тварин та асоційована з низькою продукцією VEGF. У мезенхімальних трансформантів МКС різко зростають
туморогенність, здатність до росту в агарі, продукція VEGF, але зникають ознаки
диференціювання і контактне гальмування. Для клітин субліній і клонів МКС з
«епітеліальною» морфологією характерна експресія Е-кадгерину, серії
цитокератинів та суттєве пригнічення експресії м-актину (alpha smooth muscle) і віментину, тоді як
для клітин МКС з «мезенхімальним» фенотипом — відсутність експресії
Е-кадгерину, зміна експресії кератинів та наявність експресії м-актину,
віментину і поява маркеру стовбурових клітин CD44, що свідчить про реалізацію
процесу ЕМП.
Не зважаючи на фенотипові
відмінності між клонами модальне число хромосом в клітинах вихідної лінії МКС
та її клонів складає 42 Хр, що відповідає диплоїдному числу щура (2n=42), але для всіх клонів характерне накопичення певної
кількості клітин, що несуть 37-39 хромосом (анеуплоїдне), що свідчить про
потенційне утворення ще одного модального класу. В клонах F11 і Т5 зменшення частоти метафаз, що несуть модальне
число виникає за рахунок збільшення частоти метафаз з меншим або більшим числом
хромосом, тобто виникає певна гетерогенність клональної структури за числом
хромосом.
Аналіз комплексу цитогенетичних характеристик лінії
МКС та її клонів представлений в Табл.1. На відміну від лінії МКС і клону B3F, серед
клітин клонів F11 і Т5
спостерігається висока проліферативна здатність. Майже третину клітин всіх
клонів складають поліплоїди. Явище поліплоїдії тісно пов’язане з утворенням
двоядерних клітин, які виникають внаслідок
поділів ядра, що не супроводжуються цитотомією, або в наслідок злияння
одноядерних клітин без наступного злияння ядер. В наших дослідженнях двоядерні
клітини виникають з низькою частотою, що може вказувати на відсутність зв’язку
між поліплоідією і утворенням багатоядерності.
Таблиця 1. Частота прояву цитогенетичних параметрів в клітинах лінії МКС та її субліній.
|
культура |
Частота (в %) |
Частота (в ‰) |
|||||
|
поліплоїди |
ПМК |
Мітози |
КМЯ |
Апоптози |
ДК |
протрузії |
|
|
MKC |
30,0% |
0,3±0,3 |
1,3±0,3 |
8,0±1,0 |
0,3±0,3 |
0,7±0,3 |
6,0±1,1 |
|
Клон B3F |
33,0% |
0,3±0,3 |
5,0±0,6 |
11,0±0,6 |
0 |
1,3±0,3 |
1,7±0,3 |
|
Клон F11 |
19,7% |
3,3±0,9 |
12,3±0,9 |
8,7±0,9 |
0,3±0,3 |
0,7±0,3 |
3,7±0,9 |
|
Клон T5 |
25,0% |
3,3±0,3 |
9,7±1,2 |
11,0±2,1 |
0 |
0 |
3,3±1,3 |
Незначна кількість апоптичних клітин свідчить про те, що
загибель клітин в популяціях може відбуватися шляхом мітотичної катастрофи. До
цього явища програмованої загибелі відносяться грубі порушення мітозу, такі як
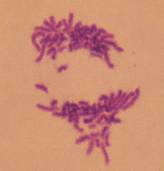
відставання хромосом в мета- та анафазі (Рис. 1, а), багатополюсні мета-
і анафази (Castedo, 2004).
Основною морфологічною ознакою цієї форми загибелі
клітини є утворення одного або декількох мікроядер (Рис. 1, б), в яких відсутнє
явище конденсації, характерне для апоптозу (Stacey Ricci, 2006; Манских, 2007).
Мікроядра не містять ядерної оболонки, вони здатні до лізису або можуть
включатися в ядро при наступному мітозі (Ильинских и др., 1992). Показано, що недостатня кількість
генетичного матеріалу, яка втрачається шляхом утворення мікроядер, може бути
компенсована за допомогою ендоредуплікації і поліплоїдії (Павлов и др., 2005).
а б
Рисунок 1. Морфологічні ознаки мітотичної катастрофи: а) відставання хромосом в анафазі, б) утворення мікроядер.
Мікроядра можуть також утворюватись шляхом немітотичної екструзії хроматину
із інтерфазного ядра (Манских, 2006). Чисельні ядерні протрузії, які ми
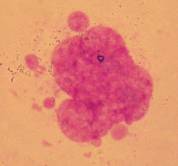
спостерігали, мають саме вигляд немітотичного поділу ядра (Рис. 2, а, б, в).
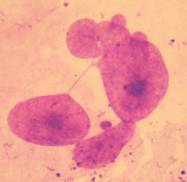
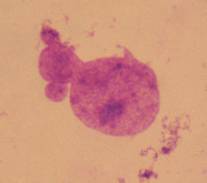
а б в
Рисунок 2. Різні варіанти ядерних протрузій в
серед клітин клону F11.
В наших дослідженнях найбільша кількість ядерних протрузій спостерігалася
серед клітин лінії МКС та клонів F11 і
Т5, у порівнянні з клоном B3F. На ядрах також можуть утворюватись ядерні вирости, які
теж пов’язують з механізмами позбавлення клітиною надлишкової ампліфікованої
ДНК. З цим же процесом пов’язують формування ацентричних і ателомерних кілець в
метафазних клітинах. Відомо, що ампліфікація генів - це стадія прогресії
пухлинних процесів в клітині (Худолей В.В., 1999).
Ще одним
попередником мітотичної катастрофи є поява клітин з передчасною конденсацією
хромосом. Висока частота зустрічальності таких клітин, пов’язана з дефектом
«точки перевірки» на стадії G2/M клітинного циклу і є одним з джерел генетичної
гетерогенності, імморталізації й адаптації клітинних популяцій до різних умов
хіміо- та радіотерапії пухлин (Bezrookove, 2003; Ricci,
2006). Ця патологія клітинного циклу може призводити до збільшення долі анеу- і поліплоїдних клітин, поява яких може
сприяти прискоренню еволюції клітин в бік злоякісності. В наших попередніх дослідженнях було виявлено, що іморталізовані і
злоякісно трансформовані клітинні лінії людини
характеризувалися високою частотою наявності клітин з передчасною
конденсацією хромосом (Kovaleva, 2007).
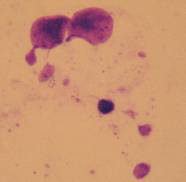
В даному дослідженні для клонів F11 і Т5 характерне підвищення частоти таких клітин, у порівнянні з вихідною
лінією і клоном B3F (Рис. 3, а, б).
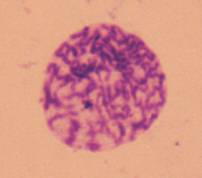
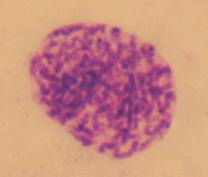
а
б
Рисунок 3. Клітини з передчасною конденсацією хромосом клону F11 (а) і Т5 (б).
Оскільки рівень проліферації для клонів не
однаковий, було оцінено співвідношення
між клітинами з попередньою конденсацією хромосом (псевдометафазні клітини) і
загальним пулом клітин, які діляться.
Таке співвідношення було запропоноване як додаткова цитогенетична
характеристика в прогнозі генетичної нестабільності клітинних популяцій
(Kovaleva, 2007). Найбільший відсоток клітин,
які дійшли до мітозу, але зупинилися на стадії G2/M клітинного циклу,
характерний для клонів F11 та
Т5 лінії МКС. Ці дані співпадають з даними, виявленими в клітинних лініях людини
і клітинах кісткового мозку
високоракової лінії мишей BALB/c
(Kovaleva, 2007).
Висновки
Встановлено,
що клітини з епітеліальним фенотипом характеризуються низькою колонієутворюючою
здатністю на відміну від мезенхімальних клонів, при цьому спостерігається чітка
кореляція з туморогенністю клітин in vivo – здатністю викликати пухлини у тварин. Крім того,
спостерігаються зміни і цитогенетичних характеристик, які асоційовані з
малігнізацією досліджених клонів. Активна проліферація, гетерогенність популяцій
за числом хромосом, збільшення частоти анеуплоїдних клітин, накопичення ядерних
аномалій і псевдометафаз в клітинах мезенхімальних клонів свідчать про їх
високозлоякісні властивості, на відміну від клонів з епітеліальним фенотипом.
Література
1. Castedo M, Perfettini JL, Roumier T et al. Cell
death by mitotic catastrophe: a molecular definition. Oncogene
2004;23:2825–2837.
2. Stacey Ricci M., Wei-Xing Zong. Chemotherapeutic Approaches for Targeting Cell Death Pathways2006Oncologist11-4-342;11;342-357
3. Манских
В.Н. Пути гибели клетки и их биологическое
значение.-2007.-Цитология.-Т49.-№11.-С.909-915.
4.
Манских В.Н. К вопросу о механизмах образования микроядер в норме и при
действии N-нитрозо-N-метилкарбамида. 2006. Бюл. эксперим. биол. мед.-141(2): 217-220
5.
Ильинских Н.Н, Новицкий В.В., Ванчугова Н.Н., Ильинских И.Н. Микроядерный
анализ и цитогенетическая нестабильность.1992. Томск. Из-во ТГУ, 272с.
6. Павлов
А.И., Гансбургский А.Н., Гансбургский М.А. Проидность микронуклеированных
тимоцитов, индуцированных введением метилнитрозомочевины. 2005 Бюл. эксперим.
биол. мед.-140(12): 695-697
7. Bezrookove V, Smits R, Moeslein G, Fodde R, Tanke HJ, Raap AK, Darroudi F Premature
chromosome condensation revisited: a novel chemical approach permits efficient
cytogenetic analysis of cancers//Genes
Chromosomes Cancer. – 2003. – V.38, N.2. – P.177-186.
8. Ricci
S. M., Zong W.-X. Chemotherapeutic Approaches for Targeting Cell Death
Pathways// The Oncologist. – 2006. - V.11. – Р.342–357
9. Kovaleva O.A., Glazko T.T., Kochubey T.P., Lukash L.L., Kudryavets Yu.I. Spontaneous premature condensation of chromosomes in normal and transformed mammal cells// Experimental oncology -2007.-V.29.,№1.- Р.18-22.